基本介紹
- 中文名:甲烷
- 英文名:methane
- 別稱:碳烷
- 化學式:CH4
- 分子量:16.043
- CAS登錄號:74-82-8
- 熔點:-182.5℃
- 沸點:-161.5℃
- 水溶性:難(常溫常壓0.03)
- 密度:0.42(-164℃)(標準情況)0.717g/L
- 外觀:常溫下為無色無氣味氣體
- 閃點:-188℃
簡介,含量分布,物理性質,化學性質與反應,取代反應,氧化反應,加熱分解,形成水合物,溫室效應,主要套用,製備方法,細菌分解法,合成法,實驗室製法,轉化途徑,安全性,健康危害,環境影響,毒理學資料,注意事項,運輸,儲存,操作,接觸限值,身體保護,急救措施,廢棄,法規,
簡介
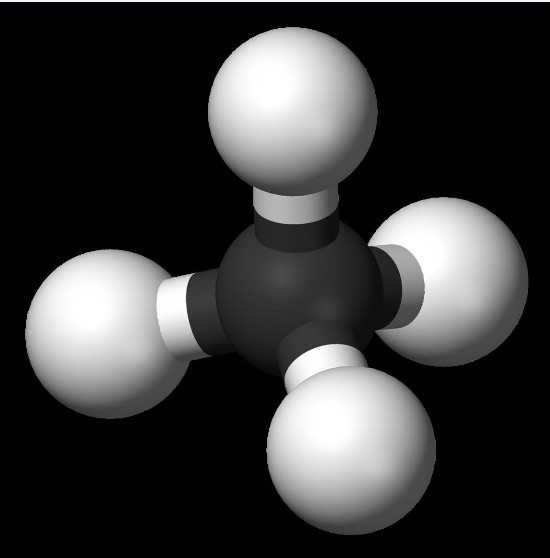
甲烷,化學式CH4,是最簡單的烴,由一個碳和四個氫原子通過sp3雜化的方式組成,因此甲烷分子的結構為正四面體結構,四個鍵的鍵長相同鍵角相等。在標準狀態下甲烷是一無色無味氣體。一些有機物在缺氧情況下分解時所產生的沼氣其實就是甲烷。從理論上說,甲烷的鍵線式可以表示為一個點“·”,但實際並沒有看到過有這種用法,可能原因是“·”號同時可以表示電子。所以在中學階段把甲烷視為沒有鍵線式。
甲烷主要是作為燃料,如天然氣和煤氣,廣泛套用於民用和工業中。作為化工原料,可以用來生產乙炔 、氫氣、合成氨、碳黑、硝氯基甲烷、二硫化碳、一氯甲烷、二氯甲烷、三氯甲烷、四氯化碳和氫氰酸等。
含量分布
天王星的大氣層也存在甲烷和氫氣。據德國核物理研究所的科學家經過試驗發現,植物和落葉都產生甲烷,而生成量隨著溫度和日照的增強而增加。另外,植物產生的甲烷是腐爛植物的10到100倍。他們經過估算認為,植物每年產生的甲烷占到世界甲烷生成量的10%到30%。行星中發現甲烷據國外媒體報導,美國天文學家19日宣布,他們首次在太陽系外一顆行星的大氣中發現了甲烷,這是科學家首次在太陽系外行星探測到有機分子,從而增加了確認 太陽系外存在生命的希望。該小組還證實了先前的猜測,即這顆名叫HD 189733b的行星的大氣中有水。
甲烷是創造適合生命存在的條件中,扮演重要角色的有機分子。美國宇航局噴氣推進實驗室的天文學家,利用繞軌運行的“哈勃”太空望遠鏡得到了一張行星大氣的紅外線分光鏡圖譜,並發現了其中的甲烷痕跡。
行星HD 189733b位於狐狸座,距地球63光年,是一類叫做“熱木星”大行星,其表面灼熱,不可能存在液態水。HD 189733b圍繞其恆星轉一圈只需兩天。由於距離恆星太近,這顆行星表面溫度高達900℃(1650華氏度),足以把銀子熔化。
不過,值得注意的是探測到甲烷。這種方法可以沿用到環繞所謂的“可居住區” (Goldilocks Zone)中溫度較低的恆星運轉的其它行星,“可居住區”不冷也不熱,正好適合孕育生命。 系外行星HD 189733b與其環繞的恆星模擬圖
系外行星HD 189733b與其環繞的恆星模擬圖
 系外行星HD 189733b與其環繞的恆星模擬圖
系外行星HD 189733b與其環繞的恆星模擬圖物理性質
顏色 | 無色 |
氣味 | 無味 |
熔點 | -182.5℃ |
沸點 | -161.5℃ |
溶解度(常溫常壓) | 0.03 |
分子結構 | 正四面體形非極性分子 |
分子直徑 | 0.414nm |
53.32kPa/-168.8℃ | |
飽和蒸氣壓(kPa) | 53.32(-168.8℃) |
相對密度(水=1) | 0.42(-164℃) |
相對密度(空氣=1) | 0.5548(273.15K、101325Pa) |
臨界溫度(℃) | -82.6 |
臨界壓力(MPa) | 4.59 |
爆炸上限%(V/V) | 15.4 |
爆炸下限%(V/V) | 5.0 |
閃點(℃) | -188 |
引燃溫度(℃) | 538 |
燃燒熱 | 890.31KJ/mol |
總發熱量(產物液態水) | 55900kJ/kg(40020kJ/m3) |
淨熱值(產物氣態水) | 50200kJ/kg(35900kJ/m3) |
H—C—H 鍵角 | 109°28′ |
C—H 鍵 | 413kJ/mol |
晶體類型 | |
國標編號 | 21007 |
IUPAC名 | methane |
別名 | 天然氣,沼氣,生物氣 |
CAS號 | 74-82-8 |
SMILES | C |
InChI | 1/CH4/h1H4 |
溶解性(水) | 3.5 mg/100 mL (17 °C) |
摩爾質量 | 16.043 g/mol |
警示術語 | R:R12 |
安全術語 | S:S2-S9-S16-S33 |
密度(標準情況) | 0.717g/L |
特殊性質 | 極難溶於水 |
化學性質與反應
通常情況下,甲烷比較穩定,與高錳酸鉀等強氧化劑不反應,與強酸、強鹼也不反應。但是在特定條件下,甲烷也會發生某些反應。
取代反應
甲烷的鹵化中,主要有氯化、溴化。甲烷與氟反應是大量放熱的,一旦發生反應,大量的熱難以移走,破壞生成的氟甲烷,只得到碳和氟化氫。因此直接的氟化反應難以實現,需用稀有氣體稀釋。碘與甲烷反應需要較高的活化能,反應難以進行。因此,碘不能直接與甲烷發生取代反應生成碘甲烷。但它的逆反應卻很容易進行。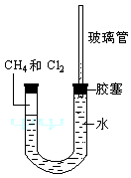

以氯化為例:可以看到試管內氯氣的黃綠色氣體逐漸變淡,有白霧生成,試管內壁上有油狀液滴生成,這是甲烷和氯氣反應的所生成的一氯甲烷、二氯甲烷、氯仿(或三氯甲烷)、四氯化碳(或四氯甲烷)、氯化氫和少量的乙烷(雜質)的混合物。
CH4+Cl2→(光照)CH3Cl(氣體)+HCl
CH3Cl+Cl2→(光照)CH2Cl2(油狀物)+HCl
CH2Cl2+Cl2→(光照)CHCl3(油狀物)+HCl
CHCl3+Cl2→(光照)CCl4(油狀物)+HCl
試管中液面上升,食鹽水中白色晶體析出,這是反應中生成的氯化氫溶於水的緣故。因為氯化氫極易溶於水,溶於水後增加了水中氯離子的濃度,使氯化鈉晶體析出。用大拇指按住試管管口,提出液面,管口向上,向試管中滴入紫色石蕊試液或鋅粒,可驗證它是稀鹽酸。
如果控制氯的用量,用大量甲烷,主要得到氯甲烷;如用大量氯氣,主要得到四氯化碳。工業上通過精餾,使混合物一一分開。以上幾個氯化產物,均是重要的溶劑與試劑。
特點:①在室溫暗處不發生反應;
②髙於250℃發生反應;
③在室溫有光作用下能發生反應;
④用光引發反應,吸收一個光子就能產生幾千個氯甲烷分子;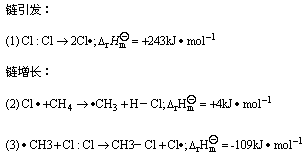
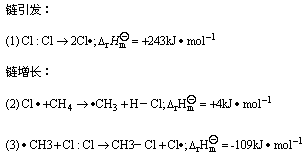
⑤如有氧或有一些能捕捉自由基的雜質存在,反應有一個誘導期,誘導期時間長短與存在這些雜質多 少有關。
根據上述事實的特點可以判斷,甲烷的氯化是一個自由基型的取代反應。如圖。
氧化反應
甲烷最基本的氧化反應就是燃燒:
CH4+2O2→CO2+2H2O
甲烷的含氫量在所有烴中是最高的,達到了25%,因此相同質量的氣態烴完全燃燒,甲烷的耗氧量最高。
點燃純淨的甲烷,在火焰的上方罩一個乾燥的燒杯,很快就可以看到有水蒸氣在燒杯壁上凝結。倒轉燒杯,加入少量澄清石灰水,振盪,石灰水變渾濁。說明甲烷燃燒生成水和二氧化碳。把甲烷氣體收集在高玻璃筒內,直立在桌上,移去玻璃片,迅速把放有燃燒著的蠟燭的燃燒匙伸入筒內,燭火立即熄滅,但瓶口有甲烷在燃燒,發出淡藍色的火焰。這說明甲烷可以在空氣里安靜地燃燒,但不助燃。用大試管以排水法先從氧氣貯氣瓶里輸入氧氣 2/3 體積,然後再通入1/3 體積的甲烷。用橡皮塞塞好,取出水面。將試管顛倒數次,使氣體充分混和。用布把試管外面包好,使試管口稍微下傾,拔去塞子,迅速用燃著的小木條在試管口引火,即有尖銳的爆鳴聲發生。這個實驗雖然簡單,但也容易失敗。把玻璃導管口放出的甲烷點燃,把它放入貯滿氯氣的瓶中,甲烷將繼續燃燒,發出紅黃色的火焰,同時看到有黑煙和白霧。黑煙是炭黑,白霧是氯化氫氣體和水蒸氣形成的鹽酸霧滴。
加熱分解
在隔絕空氣並加熱至1000℃的條件下,甲烷分解生成炭黑和氫氣
CH4=(1000℃)=C+2H2
氫氣是合成氨及汽油等工業的原料;炭黑是橡膠工業的原料
形成水合物
甲烷可以形成籠狀的水合物,甲烷被包裹在“籠”里。也就是我們常說的可燃冰。它是在一定條件(合適的溫度、壓力、氣體飽和度、水的鹽度、PH值等)下由水和天然氣在中高壓和低溫條件下混合時組成的類凍的、非化學計量的、籠形結晶化合物(碳的電負性較大,在高壓下能吸引與之相近的氫原子形成氫鍵,構成籠狀結構)。它可用mCH4·nH2O來表示,m代表水合物中的氣體分子,n為水合指數(即水分子數)。

可燃冰主要儲存於海底或寒冷地區的永久凍土帶,比較難以尋找和勘探。新研製的靈敏度極高的儀器,可以實地即時測出海底土壤、岩石中各種超微量甲烷、乙烷、丙烷及氫氣的精確含量,由此判斷出可燃冰資源存在與否和資源量等各種指標。
甲烷含量超過99%的天然氣水合物又稱為甲烷水合物。
溫室效應
2018年4月2日,美國能源部勞倫斯伯克利國家實驗室的研究人員,利用俄克拉何馬州南大平原觀測站十年來獲得的對地球大氣的綜合觀測數據,首次直接證明了甲烷導致地球表面溫室效應不斷增加。
研究人員稱,21世紀初,大氣中甲烷的濃度停滯不前,溫室效應也遵循同樣的模式;但從2007年開始,甲烷濃度開始上升的同時,其導致的溫室效應也水漲船高。
主要套用
甲烷是一種很重要的燃料,是天然氣的主要成分,約占87%。在標準壓力的室溫環境中,甲烷無色、無味;家用天然氣的特殊味道,是為了安全而添加的人工氣味,通常是使用甲硫醇或乙硫醇。在一大氣壓力的環境中,甲烷的沸點是−161 °C。空氣中的瓦斯含量只要超過5%~15%就十分易燃。液化的甲烷不會燃燒,除非在高壓的環境中(通常是4~5大氣壓力)。中國國家標準規定,甲烷氣瓶為棕色,白字。
甲烷高溫分解可得炭黑,用作顏料、油墨、油漆以及橡膠的添加劑等;氯仿和CCl4都是重要的溶劑。甲烷在自然界分布很廣,是天然氣、沼氣、坑氣的主要成分之一。它可用作燃料及製造氫、一氧化碳、炭黑、乙炔、氫氰酸及甲醛等物質的原料。甲烷用作熱水器、燃氣爐熱值測試標準燃料。生產可燃氣體報警器的標準氣,校正氣。還可用作太陽能電池,非晶矽膜氣相化學沉積的碳源。以及甲烷用作醫藥化工合成的生產原料。
除作燃料外,大量用於合成氨、尿素和炭黑,還可用於生產甲醇、氫、乙炔、乙烯、甲醛、二硫化碳、硝基甲烷、氫氰酸和1,4-丁二醇等。甲烷氯化可得一、二、三氯甲烷及四氯化碳。
製備方法
甲烷是一種可燃性氣體,而且可以人工製造,所以,在石油用完之後,甲烷將會成為重要的能源。
它主要的來源有:
- 有機廢物的分解。
- 天然源頭(如沼澤):23%。
- 從化石燃料中提取:20%。
- 動物(如牛)的消化過程:17%。
- 稻田之中的細菌:12%。
- 生物物質缺氧加熱或燃燒。
甲烷人工製法主要有以下幾種:
細菌分解法
將有機質放入沼氣池中,控制好溫度和濕度,甲烷菌迅速繁殖,將有機質分解成甲烷、二氧化碳、氫、硫化氫、一氧化碳等,其中甲烷占60%-70%。經過低溫液化,將甲烷提出,可製得廉價的甲烷。

合成法
將二氧化碳與氫在催化劑作用下,生成甲烷和氧,再提純。
CO2+2H2=CH4+O2 將碳蒸汽直接與氫反應,同樣可製得高純的甲烷。
實驗室製法
無水醋酸鈉(CH3COONa)和鹼石灰(NaOH和CaO做乾燥劑)
反應方程式:CH3COONa+NaOH===Na2CO3+CH4↑
收集:排水法(不能用向下排空氣法收集)
特點與注意事項:
- 必須用無水醋酸鈉跟乾燥的鹼石灰反應來製取甲烷,若用醋酸鈉晶體或石灰不乾燥則均幾乎不能產生甲烷氣體。
- 該實驗的操作注意事項與收集方法與氧氣的完全相同。
轉化途徑
2018年7月,上海科技大學物質科學與技術學院左智偉團隊找到了一個低成本、高效率的催化劑組合,室溫條件下,就可實現甲烷轉化。這為甲烷轉化為火箭推進劑燃料等高附加值化工產品提供了新方案,為我國高效利用特有稀土金屬資源提供了新思路。相關研究成果日前發表在國際學術期刊《科學》上。
安全性
健康危害
甲烷對人基本無毒,但濃度過高時,使空氣中氧含量明顯降低,使人窒息。當空氣中甲烷達25%-30%時,可引起頭痛、頭暈、乏力、注意力不集中、呼吸和心跳加速、共濟失調。若不及時遠離,可致窒息死亡。皮膚接觸液化的甲烷,可致凍傷。
環境影響



2.7萬次播放
07:45
北極永凍層融化釋放巨量甲烷,或加速全球變暖!
甲烷也是一種溫室氣體。GWP的分析顯示,以單位分子數而言,甲烷的溫室效應要比二氧化碳大上25倍。這是因為大氣中已經具有相當多的二氧化碳,以至於許多波段的輻射早已被吸收殆盡了;因此大部分新增的二氧化碳只能在原有吸收波段的邊緣發揮其吸收效應。相反地,一些數量較少的溫室氣體(包括甲烷在內),所吸收的是那些尚未被有效攔截的波段,所以每多一個分子都會提供新的吸收能力。
毒理學資料
毒性:急性中毒,甲烷毒性甚低,接觸高濃度甲烷時引起的“甲烷中毒”,實際上是因空氣氧含量相對降低造成的缺氧窒息。允許氣體安全地擴散到大氣中或當作燃料使用。有單純性窒息作用,在高濃度時因缺氧窒息而引起中毒。空氣中達到25~30%出現頭昏、呼吸加速、運動失調。
急性毒性:小鼠吸入2%濃度×60分鐘,麻醉作用;兔吸入2%濃度×60分鐘,麻醉作用。本品只有在極高濃度時由於空氣被置換,氧分壓降低而產生窒息。空氣中甲烷濃度87%使小鼠窒息,90%時呼吸停止。甲烷80%和氧20%的混合氣體,能引起人頭痛。當空氣中甲烷達25%~30%時,人出現窒息前症狀,如頭暈、呼吸加速、心率增加、注意力不集中、乏力、共濟失調,甚至窒息。皮膚接觸液化的甲烷可引起凍傷,甲烷主要通過呼吸道進入體內,大部分以原形呼出,少量在體內可氧化為二氧化碳和水。因其與蛋白質結合的能力極低,故麻醉作用相當弱。
人處於甲烷濃度達25%~30%的空氣中即可出現缺氧的一系列臨床表現,如頭暈、頭痛、注意力不集中、氣促、無力、共濟失調、窒息等;如濃度很高,患者可迅速死亡。曾有觀察發現甲烷中毒患者均有不同程度的中毒性腦病,中毒嚴重的患者可能有神經系統後遺症。煤礦生產中甲烷的最大危害在於與空氣混合後起火爆炸。
皮膚接觸液體甲烷時,因其迅速揮發,可造成凍傷。
慢性中毒 目前尚無慢性甲烷中毒方面的臨床資料。
診斷與鑑別診斷 根據現場存在高濃度甲烷,患者出現明顯缺氧窒息的臨床表現,與其他類似的氣體中毒或疾病鑑別後,可診斷為急性甲烷中毒。
真正的急性甲烷中毒較少,診斷時尤需注意和其他氣體中毒相鑑別。
急救與治療 急性甲烷中毒無特效解毒藥,可按缺氧的處理原則進行對症治療,如立即將患者移至空氣新鮮處、平臥、保暖、保持呼吸道通暢和吸氧等。嗎啡和巴比妥類藥物有抑制呼吸作用,應忌用。呼吸、心跳停止時需立即進行心肺腦復甦,注意防治可能出現的腦水腫,必要時作高壓氧治療。
液化甲烷污染皮膚時可造成凍傷,若凍傷處皮膚仍未解凍,可用42℃左右溫水浸洗,並按外科原則處理。
燃燒(分解)產物:碳(極不完全燃燒)、一氧化碳(不完全燃燒,有害)、二氧化碳和水(完全燃燒)。
注意事項
運輸
危險貨物編號:21007
UN編號:1971:
包裝類別:O52
包裝方法:鋼質氣瓶。
運輸注意事項:採用鋼瓶運輸時必須戴好鋼瓶上的安全帽。鋼瓶一般平放,並應將瓶口朝同一方向,不可交叉;高度不得超過車輛的防護欄板,並用三角木墊卡牢,防止滾動。運輸時運輸車輛應配備相應品種和數量的消防器材。裝運該物品的車輛排氣管必須配備阻火裝置,禁止使用易產生火花的機械設備和工具裝卸。嚴禁與氧化劑等混裝混運。夏季應早晚運輸,防止日光曝曬。中途停留時應遠離火種、熱源。公路運輸時要按規定路線行駛,勿在居民區和人口稠密區停留。鐵路運輸時要禁止溜放。
儲存
儲存於陰涼、通風的庫房。遠離火種、熱源。庫溫不宜超過30℃。應與氧化劑等分開存放,切忌混儲。採用防爆型照明、通風設施。禁止使用易產生火花的機械設備和工具。儲區應備有泄漏應急處理設備。
工程控制:生產過程密閉,全面通風。
其它有害作用:該物質對環境可能有危害,對魚類和水體要給予特別注意。還應特別注意對地表水、土壤、大氣和飲用水的污染。
操作
密閉操作,全面通風。操作人員必須經過專門培訓,嚴格遵守操作規程。遠離火種、熱源,工作場所嚴禁吸菸。使用防爆型的通風系統和設備。防止氣體泄漏到工作場所空氣中。避免與氧化劑接觸。在傳送過程中,鋼瓶和容器必須接地和跨接,防止產生靜電。搬運時輕裝輕卸,防止鋼瓶及附屬檔案破損。配備相應品種和數量的消防器材及泄漏應急處理設備。
接觸限值
中國:制定中
前蘇聯MAC(mg/m3):300
美國 車間衛生標準 窒息性氣體
TLVTN:ACGIH窒息性氣體
TLVWN:未制定標準
身體保護
呼吸系統防護:一般不需要特殊防護,但建議特殊情況下,佩帶自吸過濾式防毒面具(半面罩)。
眼睛防護:一般不需要特別防護,高濃度接觸時可戴安全防護眼鏡。
身體防護:穿防靜電工作服。
手防護:戴一般作業防護手套。
其它:工作現場嚴禁吸菸。避免長期反覆接觸。進入罐、限制性空間或其它高濃度區作業,須有人監護。
急救措施
皮膚接觸或眼睛接觸:皮膚或眼睛接觸液態甲烷會凍傷,應及時就醫。
吸入:迅速脫離現場至空氣新鮮處。保持呼吸道通暢。如呼吸困難,給輸氧。如呼吸停止,立即進行人工呼吸。就醫。
滅火方法:切斷氣源。若不能立即切斷氣源,則不允許熄滅正在燃燒的氣體。噴水冷卻容器,可能的話將容器從火場移至空曠處。
滅火劑:霧狀水、泡沫、二氧化碳、乾粉。
泄露:迅速撤離泄漏污染區人員至上風處,並進行隔離,嚴格限制出入。切斷火源。建議應急處理人員戴自給正壓式呼吸器,穿消防防護服。儘可能切斷泄漏源。合理通風,加速擴散。噴霧狀水稀釋、溶解。構築圍堤或挖坑收容產生的大量廢水。如有可能,將漏出氣用排風機送至空曠地方或裝設適當噴頭燒掉。也可以將漏氣的容器移至空曠處,注意通風。漏氣容器要妥善處理,修復、檢驗後再用。
廢棄
處置前應參閱國家和地方有關法規。建議用焚燒法處置。
法規
化學危險物品安全管理條例(1987年2月17日國務院發布),化學危險物品安全管理條例實施細則(化勞發[1992]677號),工作場所安全使用化學品規定([1996]勞部發423號)等法規,針對化學危險品的安全使用、生產、儲存、運輸、裝卸等方面均作了相應規定;常用危險化學品的分類及標誌(GB13690-92)將該物質劃為第2.1類易燃氣體。