發現簡史
1834年
麥可·法拉第首次使用
電解乙酸鉀的方法製造了乙烷。他錯誤地以為這個反應的產物是甲烷,因此沒有繼續研究。
在1847年和1849年間
阿道夫·威廉·赫爾曼·科爾貝和愛德華·弗蘭克蘭在維護有機化學理論的過程中通過使用金屬鉀還原
丙腈和
碘乙烷以及通過電解乙酸鹽的方法製造了乙烷。但是他們錯誤地以為這些反應的產物是甲基
自由基,而不是甲基的
二聚體乙烷。
1864年
卡爾·肖萊馬校正了這個錯誤,他證明所有這些反應的產物都是乙烷。
物理性質
基本性質
外觀與性狀: 無色無臭氣體。
熔點(℃): -183.3
沸點(℃): -88.6
相對密度(水=1): 0.45
相對蒸氣密度(空氣=1): 1.04
飽和蒸氣壓(kPa): 53.32(-99.7℃)
燃燒熱(kJ/mol): 1558.3
臨界溫度(℃): 32.2
臨界壓力(MPa): 4.87
閃點(℃): <-50
引燃溫度(℃): 472
爆炸上限%(V/V): 16.0
爆炸下限%(V/V): 3.0
溶解性: 不溶於水,微溶於乙醇、丙酮,溶於苯,與四氯化碳互溶
構像
乙烷的C-C單鍵可以自由旋轉,如果
乙烷中的一個C原子不動,另一個繞C-C單鍵自由旋轉,則一個C原子上的3個H相對於另一個C原子上的3個H可以有無數的空間排列。這種由於
單鍵旋轉而產生的分子中的原子或基團在空間的不同排列形式叫做
構象,每一個個構象就叫做一個
構象異構體,由於C-C單鍵自由旋轉,乙烷可以有無數種構象,乙烷的
優勢構象是交叉式。這個時候2個C原子上的H距離最遠相互間的排斥力最小,因而
分子內能最低 也最穩定。內能最高的是重疊式,這時2個C上的H兩兩相對,相互間的排斥力最大,內能最高,最不穩定,其他的構象內能介於這兩者之間。在旋轉過程中,由於兩個甲基上的
氫原子的相對位置不斷發生變化,這就形成了許多不同的空間排列方式。其中一種是一個甲基的氫原子正好處在另一個甲基的兩個氫原子之間的中線上。這種排布方式叫做交叉式構像。另一種是兩個碳原子上的各個氫原子正好處在相互對映的位置上。這種排布方式叫重疊構像。交叉式和重疊式是乙烷無數構像中的兩種極端情況。
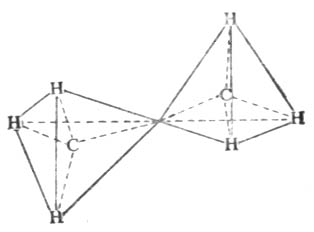 乙烷的交叉式構象
乙烷的交叉式構象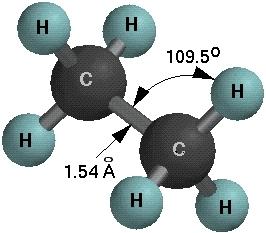 C H夾角為111.17,非109.5
C H夾角為111.17,非109.5乙烷單鍵的旋轉也並不是完全自由的。可以把這個能壘看作是克服
氫原子的斥力,以及很可能還有由於碳氫原鍵
電子云之間的斥力所需要的能量。重疊式由於前後兩個氫原子相距最近,以及碳氫鍵間8電子云斥力最大,所以能量最高,交叉式中C-H相距最遠,斥力最小,能量最低,是乙烷最有利的構像。
化學性質
乙烷是低級烷烴的一種,能發生很多烷烴的典型反應
鹵化反應
在
紫外光或熱(250~400℃)作用下,與氯反應得氯代烷
CH3CH3+Cl2→CH3CH2Cl+HCl
硝化反應
與
硝酸或
四氧化二氮(N
2O
4)進行氣相(400~450℃)反應,生成
硝基化合物(RNO
2)。 這種直接生成硝基化合物的反應叫做
硝化(nitration),它在工業上是一個很重要的反應。它之所以重要是由於硝基烷烴可以轉變成多種其它類型的化合物,如
胺、
羥胺、
腈、醇、
醛、
酮及
羧酸等。此外,硝基烷烴可以發生多種反應,故在近代文獻中有關硝基烷烴的套用的報導日益增多。 在實驗室中採用氣相硝化法有很大的局限性,所以實驗室內主要通過間接方法製備硝基烷烴。 氣相硝化法製備硝基烷烴,常得到多種硝基化合物的混合物。
CH3CH3+HONO2→CH3CH2NO2+H2O
磺化及氯磺化
烷烴在高溫下與硫酸反應,和與硝酸反應相似,生成烷基磺酸,這種反應叫做
磺化(sulfcmation)。
CH3CH3+HOSO3H→CH3CH2SO3H+H2O
燃燒
乙烷能燃燒,即發生劇烈的氧化反應。完全燃燒時,反應物全被破壞,生成二氧化碳和水,同時放出大量熱。
2CH3CH3+7O2→4CO2+6H2O
主要用途
裂解製造乙烯
在化學工業里乙烷主要用來通過蒸汽裂解生產乙烯。與蒸汽混合被加到攝氏900度或以上的高溫時重的碳氫化合物裂解成輕的碳氫化合物,
烷烴成為
烯烴。相對於其它比較重的原材料而言乙烷在蒸汽裂解過程中相當大的部分成為乙烯,而比它重的化合物則會產生許多混合物,其中包括許多重的烯烴如
丙烯、
丁二烯以及
芳香烴,降低
乙烯的成分。
製冷劑
乙烷可以在冷凍設施中作為致冷劑使用。在科學研究中液態的乙烷在
電子顯微技術中被用來使得含水量高的樣本透明化。薄的水層在快速沉浸到設施-150度或更低的液乙烷中時迅速凍結,不會形成晶體。這樣的迅速凍結不會像冰結晶時那樣會破壞液態水中軟物質的結構。
生產工藝
來源:本品存在於石油氣、天然氣、焦爐氣及石油裂解氣中,經分離而得。
從油田氣分離 油田氣或天然氣除主要含甲烷以外,還含有少量乙烷、丙烷或其他更多碳原子的烴,在天然氣中的含量約5%一10%,僅次於甲烷,經分離可得乙烷。由天然氣深冷分離而得的液析液,是以乙烷、
丙烷。丁烷為主要組分的輕質
烴類混合物,其組成與天然氣的來源及分離加工溫度、壓力條件有關,典型組成(P)為:乙烷37.6%、丙烷35.9%、丁烷11.6%、
異丁烷3.9%、
正戊烷3.1%、其他7.9%。
從煉廠氣分離 在各煉廠石油加工氣體中,除含有甲烷以外,還含有乙烷、丙烷以及碳四和碳五烴等,經分離可得乙烷。
從裂解氣分離 用深冷法可以分出乙烷。
運輸與安全
運輸事項
危險貨物編號: 21009
UN編號: 1035
包裝類別: O52
包裝方法: 鋼質氣瓶。
具體事項: 密閉操作,全面通風。操作人員必須經過專門培訓,嚴格遵守操作規程。操作人員應身穿防靜電工作服。遠離火種、熱源,工作場所嚴禁吸菸。使用防爆型的通風系統和設備。防止氣體泄漏到工作場所空氣中。避免與氧化劑、鹵素接觸。在傳送過程中,鋼瓶和容器必須接地和跨接,防止產生
靜電。搬運時輕裝輕卸,防止鋼瓶及附屬檔案破損。配備相應品種和數量的消防器材及泄漏應急處理設備。採用剛瓶運輸時必須戴好鋼瓶上的安全帽。鋼瓶一般平放,並應將瓶口朝同一方向,不可交叉;高度不得超過車輛的防護欄板,並用三角木墊卡牢,防止滾動。運輸時運輸車輛應配備相應品種和數量的消防器材。裝運該物品的車輛排氣管必須配備阻火裝置,禁止使用易產生火花的機械設備和工具裝卸。嚴禁與氧化劑、鹵素等混裝混運。夏季應早晚運輸,防止日光曝曬。中途停留時應遠離火種、熱源。公路運輸時要按規定路線行駛,勿在居民區和人口稠密區停留。鐵路運輸時要禁止溜放。
 乙烷泄漏報警器
乙烷泄漏報警器儲存事項
儲存於陰涼、通風的庫房。遠離火種、熱源。庫溫不宜超過30℃。應與氧化劑、鹵素分開存放,切忌混儲。採用防爆型照明、通風設施。禁止使用易產生火花的機械設備和工具。儲區應備有泄漏應急處理設備。
工程控制: 生產過程密閉,全面通風。
呼吸系統防護: 一般不需要特殊防護,但建議特殊情況下,佩戴自吸過濾式
防毒面具(半面罩)。
身體防護: 穿防靜電工作服。
手防護: 戴一般作業防護手套。
其他防護: 工作現場嚴禁吸菸。避免長期反覆接觸。進入罐、限制性空間或其它高濃度區作業,須有人監護。
職業接觸限值:前蘇聯MAC(mg/m
3): 300
 手持式乙烷報警器
手持式乙烷報警器法規信息
化學危險物品安全管理條例(1987年2月17日國務院發布),化學危險物品安全管理條例實施細則 (化勞發[1992] 677號),工作場所安全使用化學品規定 ([1996]勞部發423號)等法規,針對化學危險品的安全使用、生產、儲存、運輸、裝卸等方面均作了相應規定;常用危險化學品的分類及標誌 (GB 13690-92)將該物質劃為第2.1 類易燃氣體。
 乙烷的交叉式構象
乙烷的交叉式構象 C H夾角為111.17,非109.5
C H夾角為111.17,非109.5 乙烷泄漏報警器
乙烷泄漏報警器 手持式乙烷報警器
手持式乙烷報警器