基本介紹
- 中文名:點陣能
- 外文名:Lattice Energy
- 別名:晶格能
- 單位:千焦/摩爾
定義
點陣能
測定
理論公式
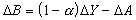 公式
公式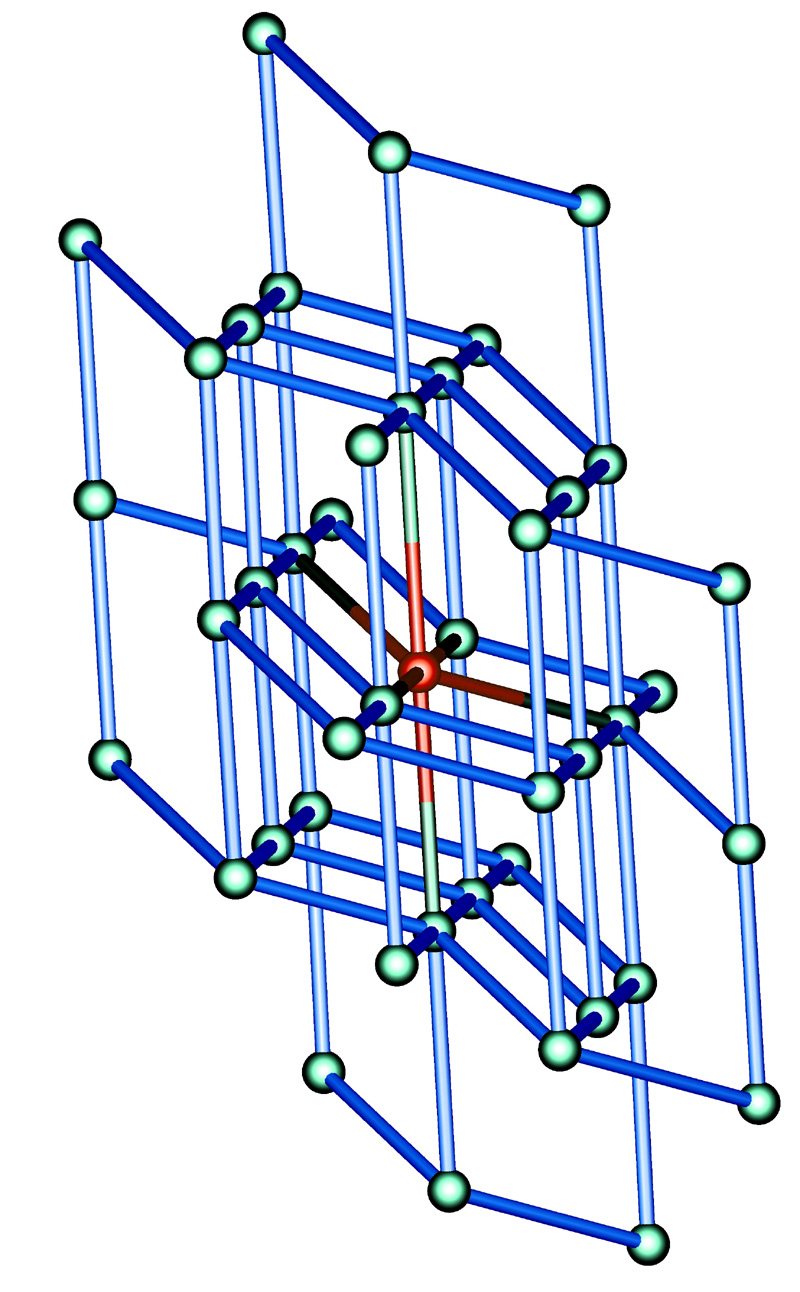
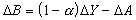 公式
公式亦稱晶格能。是指由相互遠離的氣態離子或分子形成1mol化合物晶體所釋放出的能量。晶格能是衡量晶體中離子間或分子間鍵結合能總體大小的一個量度。...
晶體的基本特徵是其內部結構的周期性,那么很自然就應當把原子排列與空間的網點陣列聯繫起來。後者稱為空間點陣,或簡稱為點陣。點陣中各個點的環境是彼此相同的。...
點陣雷射技術是一種皮膚美容技術,是介於有創和無創之間的一種微創治療。 點陣雷射治療理論英文稱為 Fractional Photothermolysis(點陣式光熱分解作用)理論,是由美國...
點陣字型是把每一個字元都分成16×16或24×24個點,然後用每個點的虛實來表示字元的輪廓。點陣字型也叫點陣圖字型,其中每個字形都以一組二維像素信息表示。...
螢幕上文字的顯示,既由一個個小點組成的陣,又稱之為像素,通常點越多其像素越高,由多點數排列。由許多點陣方格構成的,點越多,解析度越高,也越清晰。 現有多...
點陣發光字是採用鐵皮烤漆字打孔後製作成型。各種板材打孔均可使用(例如電解板,鋁塑板,鐵板,不鏽鋼板等)!一般做成發光字。...
點陣圖是由n多的像素組成的。它的概念主要是相對於區別矢量圖而言的。點陣圖和矢量圖是現代計算機平面圖形的兩大概念。...
點陣圖,也叫做點陣圖,刪格圖象,像素圖,簡單的說,就是最小單位由象素構成的圖,縮放會失真。...
點陣屏技術以全彩為例是將192顆LED晶片三色一組封裝在一個模組上,由模組組成單元板,由單元板組成顯示屏。...
LED點陣屏通過LED(發光二極體)組成,以燈珠亮滅來顯示文字、圖片、動畫、視頻等,是各部分組件都模組化的顯示器件,通常由顯示模組、控制系統及電源系統組成。LED點陣...
點陣液晶釋義:點陣液晶,是按照一定規則排列起來的列陣。常見的有圖行點陣液晶模組。...
點陣圖像也叫做點陣圖,柵格圖象,像素圖,簡單的說,就是最小單位由象素構成的圖,縮放會失真。...
點陣區(Dot Zone)是一款考驗耐心和技巧的遊戲。...... 《點陣區Dot Zone》Android是一款十分有趣的休閒益智類遊戲,遊戲畫面簡潔,非常考驗耐心和技巧。...
點陣印表機是將計算機的運算結果或中間結果以人所能識別的數字 、字母、符號和圖形等,依照規定的格式印在紙上的設備。印表機正向輕、薄、短、小、低功耗、高速度...
大螢幕LED點陣顯示系統 本文所設計的是一個同等灰度的單色LED顯示屏控制系統,該控制系統以AT89S51為控制器,採用RS-232通信標準,可顯示漢字、字元、數字或單色圖片...
晶體中的原子(或離子、分子、原子集團)在空間作周期性排列,構成有序的點陣結構。在各個溫度下,晶體中的原子都在其平衡位置附近作不斷的熱振動,晶體的比熱容、熱...
顯示點陣就是指在顯示屏上長和寬各能顯示出多少個像素點,或者在LED顯示屏上長和寬有多少個LED會同時發光。 ...
點陣式顯示屏,一種顯示屏,其材質多為LCD或LED,廣泛套用於廣告牌或電子計算器。點陣顯示器有單色亦可彩色。單色點陣顯示器通常一個點為一個像素點,彩色點陣顯示器...
點陣數碼筆是一種通過在普通紙張上印刷一層不可見的點陣圖案,數碼筆前端的高速攝像頭隨時捕捉筆尖的運動軌跡,同時壓力感測器將壓力數據傳回數據處理器,最終將信息通過...
現在已能用電子顯微鏡對晶體內部結構進行觀察和照相,更有力地證明假想的正確性。詞條標籤: 學科, 化學 圖集 晶體點陣圖冊 V百科往期回顧 詞條統計 瀏覽次數:次...
