離子使異號離子極化而變形的作用稱為該離子的“極化作用”;被異號離子極化而發生離子電子云變形的性能稱為該離子的“變形性”。
基本介紹
- 中文名:極化作用
- 外文名:polarization
- 電荷:陽離子電荷越高,極化力越強
- 半徑:陽離子外殼相似電荷相等,半徑小
- 引起:相互極化和附加極化作用
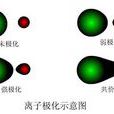
離子使異號離子極化而變形的作用稱為該離子的“極化作用”;被異號離子極化而發生離子電子云變形的性能稱為該離子的“變形性”。
極化(polarisation),指事物在一定條件下發生兩極分化,使其性質相對於原來狀態有所偏離的現象。如分子極化(偶極矩增大)、光子極化(偏振)、電極極化等。表征均勻平面波...
離子使異號離子極化而變形的作用稱為該離子的“極化作用”;被異號離子極化而發生離子電子云變形的性能稱為該離子的“變形性”。離子極化理論是離子鍵理論的重要...
離子的極化(Ionic polarization)由法揚斯(Fajans)首先提出。離子極化指的是在離子化合物中,正、負離子的電子云分布在對方離子的電場作用下,發生變形的現象。離子極化...
離子極化理論是離子鍵理論的重要補充。離子極化理論認為:離子化合物中除了起主要作用的靜電引力之外,誘導力起著很重要的作用。離子本身帶電荷,陰、陽離子接近時,在...
無論是非極性分子還是極性分子,在外電場作用下,分子內的正、負電荷中心都會發生相對位移,產生誘導偶極,這一過程叫作分子極化。極性分子在無外電場作用時所具有的...
當有電流通過時,由於電化學反應進行的遲緩性造成電極帶電程度與可逆情況時不同,從而導致電極電勢偏離的現象,稱為電化學極化(Electro-chemical polarization)。其特點...
電介質極化是指外電場作用下,電介質顯示電性的現象。理想的絕緣介質內部沒有自由電荷,實際的電介質內部總是存在少量自由電荷,它們是造成電介質漏電的原因。 一般...
極化效應是梯度經濟理論之一。最早是由經濟學家G·邁達爾在其著作《經濟理論和不發達地區》 (1957年) 中提出的。這種理論認為,在市場機制的作用下,一旦地區間發展...
通常把在—定電流密度作用下的電極電位與相對平衡的電極電位的差值,稱為電極極化。常見的有電化學極化、濃差極化等。由電極極化作用引起的電動勢叫做超電壓[1] 。...
陰極極化(cathodic polarization)指原電池中的陰極電位,在通過電流之後,向負的方向移動的現象。在電化學研究中,很多電化學反應表現在電極的極化上,因此測量電極的極化...
離子極化的強弱取決於兩個因素:一是離子的極化力;二是離子的變形性。離子的極化力是指某種離子使異號離子極化(即變形)的能力。...
在電場(外電場或離子本身電荷產生的)作用下,離子的電子云發生變化,產生偶極或使原來偶極增大,這種現象叫做離子的極化。...
每個電疇中原來已經具有的極化強度,常用Ps表示。在電滯回線上可用外推法將場強E=0,所對應的場強即為自發極化強度。...
極化電位就是電極在通過電流後的電極電位,分陽極極化電位和陰極極化電位。...... 極化電位就是電極在通過電流後的電極電位...極化又稱極化作用、極化現象。V百科往期...
電極化強度是指電介質極化程度和極化方向的物理量,是一個無量綱的純數,電極化強度P定義為單位體積內分子電偶極矩p的矢量和。...
在人工電流場—磁場或激發場作用下,具有不同電化學性質的岩石或礦石,由於電化學作用將產生隨時間變化的二次電場(激發極化場)。這種物理化學作用稱為激發極化效應。...
