熱化學是物理化學的一個分科。研究物理和化學變化過程中熱效應的規律。以熱力學第一定律為基礎。以在卡計中直接測量熱效應為重要實驗方法。熱化學的數據(如燃燒熱、生成熱等)在熱力學計算、工程設計和科學研究、安全工程等方面都具有廣泛的套用。
基本介紹
簡介
定律
 熱化學脫水器
熱化學脫水器化學反應熱效應
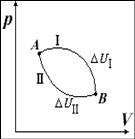
恆容反應熱QV
恆壓反應熱QP
研究方向
氣相沉積
溫度
 第一定律和熱化學
第一定律和熱化學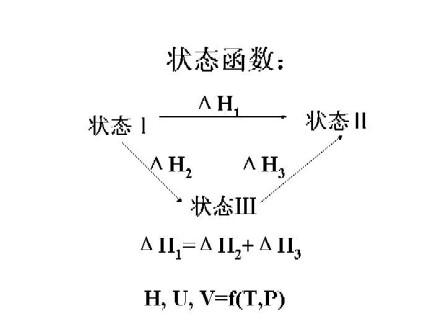 熱化學定律
熱化學定律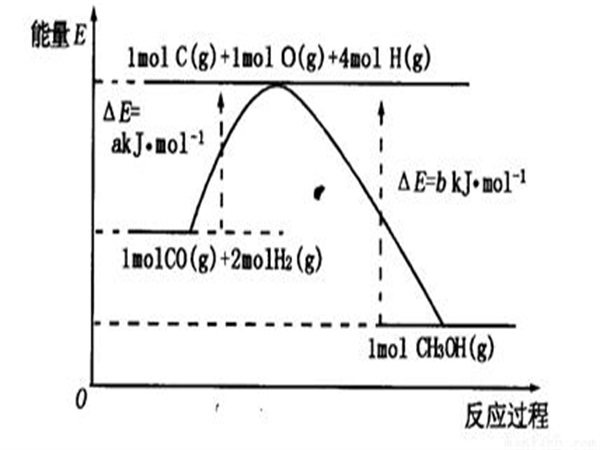
熱化學是物理化學的一個分科。研究物理和化學變化過程中熱效應的規律。以熱力學第一定律為基礎。以在卡計中直接測量熱效應為重要實驗方法。熱化學的數據(如燃燒熱、生成熱等)在熱力學計算、工程設計和科學研究、安全工程等方面都具有廣泛的套用。
 熱化學脫水器
熱化學脫水器 第一定律和熱化學
第一定律和熱化學 熱化學定律
熱化學定律熱化學是物理化學的一個分科。研究物理和化學變化過程中熱效應的規律。以熱力學第一定律為基礎。以在卡計中直接測量熱效應為重要實驗方法。熱化學的數據(如燃燒熱...
熱化學方程式(thermochemical equation)是用以表示化學反應中的能量變化和物質變化。熱化學方程式的意義為熱化學方程式不僅表明了一個反應中的反應物和生成物,還表明了...
熱化學數據(thermochemical data)是指與物理和化學變化的熱效應有關的基礎數據,通常指熱容、相變熱、化學反應熱和混合熱等,是化工熱力學研究的一類基礎數據,在熱力...
熱化學方法是研究化學變化熱效應的方法。化學變化和物理變化的過程中常伴有吸熱或放熱現象,本法即對這些熱效應進行測定、歸納並研究其規律性,是物理化學方法中建立和...
化學熱力學是物理化學和熱力學的一個分支學科,它主要研究物質系統在各種條件下的物理和化學變化中所伴隨著的能量變化,從而對化學反應的方向和進行的程度作出準確的...
化學反應中的能量變化 化學反應中的能量變化,通常表現為熱量的變化。探討化學反應放熱、吸熱的本質時,要注意四點:①化學反應的特點是有新物質生成,新物質和反應物...
熱化學資料庫是儲存有多種物質的熱化學數據以及有關管理、調用這些數據作熱化學計算的程式系統。...
是將鋼件置於一定溫度的特定介質中保溫,使介質中的活性原子滲入鋼件表層,從而改變表層化學成分和組織來改變其性能的一種熱處理工藝。 ...
化學方程式,也稱為化學反應方程式,是用化學式表示化學反應的式子。化學方程式反映的是客觀事實。因此書寫質量守恆定律。用化學式(有機化學中有機物一般用結構簡式)...
熱化學平衡是化學平衡的一種類型。指受溫度高低的影響會使平衡移動的一種可逆反應。...
本書首先介紹了地球上的各種生物質資源,生物質碳氫循環的生態保護原理,從材料學、高分子化學和高分子物理的角度,描述了生物質的材料學和化學特性,為生物質熱化學...
2011年4月6日,國家科技部來文,同意依託武漢凱迪控股投資有限公司申報的“生物質熱化學技術國家重點實驗室”立項。這是繼成功依託武漢郵電科學研究院組建“新一代...
《純物質熱化學數據手冊(套裝上下冊)》是科學出版社出版。包含近3300組物質與物相的熱化學數據,溫度範圍最高可達3500度。《純物質熱化學數據手冊(套裝上下冊)》與...
爆炸熱化學參數表示炸藥在爆轟化學反應過程中,爆炸性能與威力大小的參數,屬於坑探工程學科。...
STM熱化學燒孔效應與超高密度信息存儲,是一個論文,作者雷曉鈞,導師蔡生民,劉忠范。...... STM熱化學燒孔效應與超高密度信息存儲,是一個論文,作者雷曉鈞,導師蔡生...
中文名稱 複合材料熱化學模型 英文名稱 thermochemical model of composite 定義 描述複合材料由熱引發的固化反應進程與溫度和時間的相互關係的模型。 套用學科 材料...
化工熱力學(chemical engineering thermodyna-mics)是指化學工程的一個分支,是熱力學基本定律套用於化學工程領域而形成的一門學科。主要研究化學工程中各種形式的能量...
在一定溫度和壓力下,由最穩定的單質生成1摩爾純物質的熱效應。...... 生成熱化學 編輯 生成熱概念 在一定溫度和壓力下,由最穩定的單質生成1摩爾純物質的熱效應。...
標準燃燒熱是在標態及TK條件下以確定的穩定產物的焓值為0反應物的相對焓值。...... 熱化學方程式的含義:碳的標準燃燒熱為-393.5kJ/mol,表示在100kPa時,1mol碳...
