電解分析建立在電解基礎上通過稱量沉積於電極表面的沉積物重量以測定溶液中被測離子含量的電化學分析法,是重量分析方法的一種。電解分析包括控制外加電壓電解分析、控制陰極電位電解分析、控制電流電解和汞陰極電解法。
基本介紹
- 中文名:電解分析
- 外文名:Electrolysis
- 別稱:電重量分析
- 學科:電化學分析
電解分析的定義
電解分析的基本原理
電解
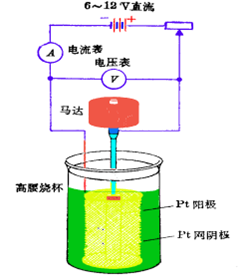
電解分析建立在電解基礎上通過稱量沉積於電極表面的沉積物重量以測定溶液中被測離子含量的電化學分析法,是重量分析方法的一種。電解分析包括控制外加電壓電解分析、控制陰極電位電解分析、控制電流電解和汞陰極電解法。

電解分析建立在電解基礎上通過稱量沉積於電極表面的沉積物重量以測定溶液中被測離子含量的電化學分析法,是重量分析方法的一種。...
電解分析法 electrolytic analysis 建立在電解基礎上通過稱量沉積於電極表面的沉積物重量以測定溶液中被測離子含量的電化學分析法。又稱電重量分析法。...
電解(Electrolysis)是將電流通過電解質溶液或熔融態電解質,(又稱電解液),在陰極和陽極上引起氧化還原反應的過程,電化學電池在外加直流電壓時可發生電解過程。利用在...
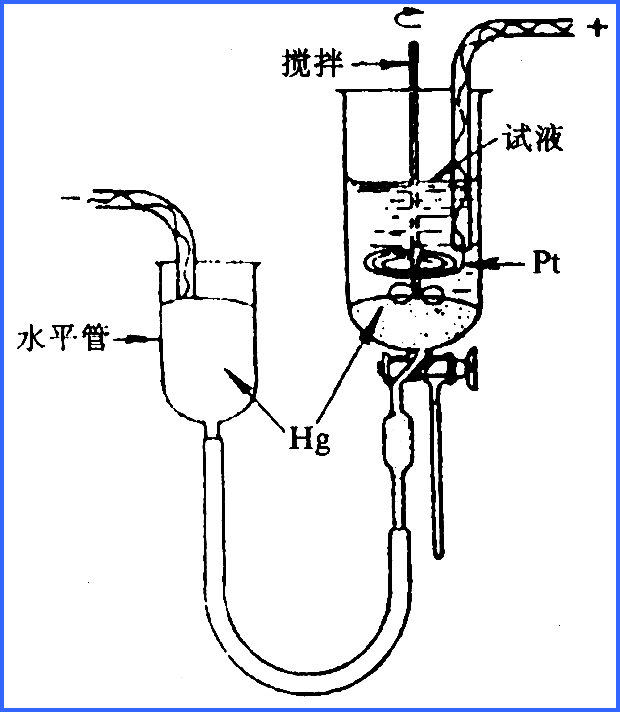
控制電位電解分析法cantroll}d potential cle}tr}metry 在控制上作電極(陰極或陽極)電位為一恆定值的條件下進行 電解的分析方法。 ...
電化學分析法是套用電化學原理和技術,利用化學電池內被分析溶液的組成及含量與其電化學性質的關係而建立起來的一類分析方法。其,操作方便,廣。許多電化學分析法既可...
電解法是利用直流電進行氧化還原反應的方法,原理是電流通過物質而引起化學變化,該化學變化是物質失去或獲得電子(氧化或還原)的過程。電解時,把電能轉變為化學能的...
電化學分析方法是根據電化學原理建立起來的一類分析方法的總稱。這類方法的共同特點是在進行測定時使試樣溶液構成一個電化學電池的組成部分,然後測量電池的某些參數,...
電分析化學法是套用電化學的基本原理和技術,研究在化學電池內發生的特定現象,利用物質的組成及含量與該電池的電學量,如電導、電位、電流、電荷量等有一定的關係而...
電分析化學--Electroanalytical Chemistry 電分析化學是儀器分析的一個重要的分支,它是以測量某一化學體系或試樣的電回響為基礎建立起來的一類分析方法。它把測定的...
