sp2雜化是由同一層的一個s軌道與3個p軌道中的兩個形成,多用於形成兩個單鍵與一個雙鍵,即形成有機物中的烯烴、醛、酮、醯等。Sp2軌道雜化是基於軌道雜化理論的一個重要分支,是一種比較常見的軌道雜化方式。
基本介紹
- 中文名:sp2雜化
- 外文名:sp2 hybridization
- 屬性:雜化方式
- 所屬學科:化學、物理
定義
具體形成過程
乙烯
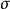
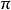
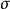
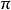
sp2雜化是由同一層的一個s軌道與3個p軌道中的兩個形成,多用於形成兩個單鍵與一個雙鍵,即形成有機物中的烯烴、醛、酮、醯等。Sp2軌道雜化是基於軌道雜化理論的一個重要分支,是一種比較常見的軌道雜化方式。
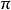
sp2雜化是由同一層的一個s軌道與3個p軌道中的兩個形成,多用於形成兩個單鍵與一個雙鍵,即形成有機物中的烯烴、醛、酮、醯等。Sp2軌道雜化是基於軌道雜化理論...
雜化軌道理論(Hybrid Orbital Theory)是1931年由鮑林(Pauling L)等人在價鍵理論的基礎上提出,它實質上仍屬於現代價鍵理論,但是它在成鍵能力、分子的空間構型等方面...
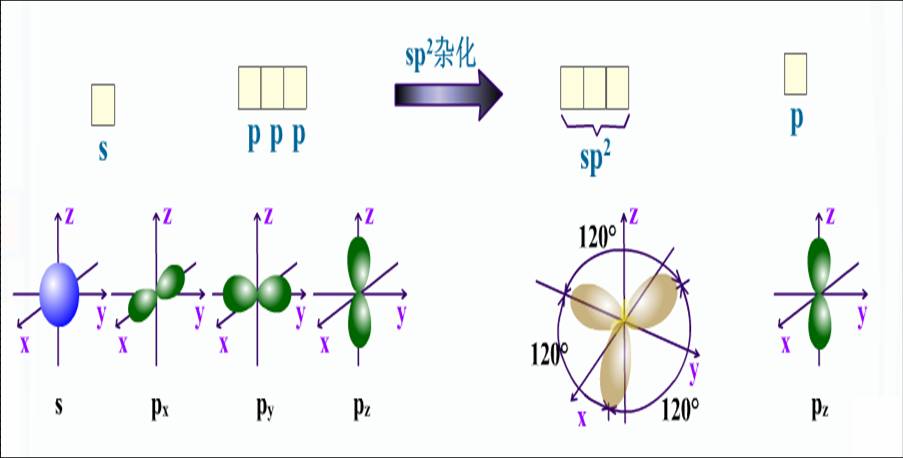
sp2雜化:原子以一個ns和兩個np軌道雜化,形成三個能量相同sp2雜化軌道,每個雜化軌道各含1/3s成分和2/3p成分。三個雜化軌道間的夾角為120度。...
乙烯是最普遍的sp2雜化形式,碳原子在形成乙烯分子時,每個碳原子的2s軌道與兩個2p軌道發生雜化,稱為sp2雜化,其形狀與sp3雜化軌道相似,在空間以碳原子為中心指向平面...
只有s軌道和p軌道參與的雜化,主要有以下三種類型:sp1雜化,sp2雜化,sp3雜化。sp雜化軌道角度分布及其空間伸展方向示意圖 (2)s-p-d型雜化...
雜化類型有 sp雜化、sp2雜化、sp3雜化 SP2sp2雜化 同一原子內由一個ns軌道和二個np軌道發生的雜化,稱為sp2雜化。雜化後組成的軌道稱為sp2雜化軌道。氣態氟化硼...
其中sp2雜化為平面三角形,sp3d雜化為三角雙錐。中文名 三角雜化 含義 雜化後軌道的構型為三角 包含 sp2,sp3d 分別 平面三角型,三角雙錐 屬於 雜化軌道理論...
電子雜化就是化學理論中的一個重要的內容,當原子相互接觸成鍵時,幾個原子的電子互相組合成為新的軌道,以利於成鍵。在同一個原子中,能量相近的不同類型的幾個...
軌道雜化概念,是由美國化學家鮑林在1931年首先提出的,經過不斷深化和完善,現已成為當今化學鍵理論的重要內容之一。...
碳碳雙鍵是指由碳的一個2s亞層和兩個2P亞層雜化為三個sp2雜化軌道。這三個sp2雜化軌道分布在同一平面上。鍵能大於單鍵。...
帶正電荷的碳原子是sp2雜化狀態,三個sp2雜化軌道與其他三個原子的軌道形成σ鍵,構成一個平面,鍵角接近120°,碳原子剩下的p軌道與這個平面垂直,p軌道中無電子。...
因此經sp2雜化而形成的分子具有平面三角形的構型。 [1] 分子空間構型sp3雜化 2s軌道與2p軌道實行sp3雜化後,已經成對的兩個電子占據一個雜化軌道,三個未成對電子...
