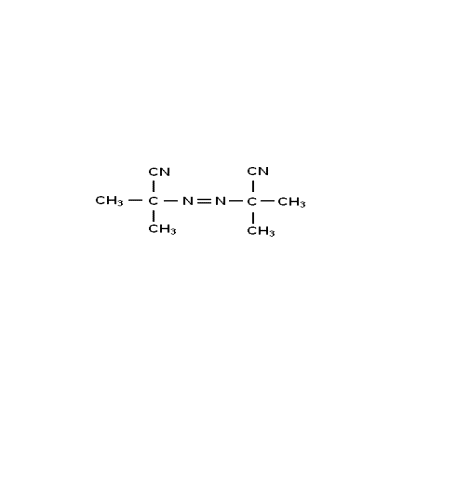
電子轉移引發劑,由電子給體和電子受體間形成的電荷轉移絡合物,會分別分離生成正離子、負離子或自由基,可被用作自由基聚合和離子型聚合的引發劑,統稱為電子轉移引發劑。
基本介紹
- 中文名:電子轉移引發劑
- 外文名:charge-transfer initiator
- 類型:正離子、負離子或自由基
- 引發:自由基聚合和離子型聚合
- 學科:化學
自由基聚合引發劑,引發劑的分類,偶氮化合物類,過氧化物介紹,離子型聚合引發劑,陽離子聚合,陰離子聚合,
自由基聚合引發劑
自由基引發劑,簡稱引發劑。指一類容易受熱分解成自由基(即初級自由基)的化合物,可用於引發烯類、雙烯類單體的自由基聚合和共聚合反應,也可用於不飽和聚酯的交聯固化和高分子交聯反應。自由基聚合是研究最早、工業化套用最廣泛的聚合反應。與其他聚合曆程相比,自由基聚合具有單體來源廣泛、工藝簡單、價格低廉、產品豐富的特點,因而一直受到人們的重視。自由基聚合的不足在於對聚合物相對分子質量、分子質量分布、序列結構、立體結構的控制不如其他聚合曆程理想。
引發劑的分類
自由基引發劑(initiators for free radical polymerization)的分類,有多種分類方法,按引發劑的分子結構,可以分為偶氮類、過氧類和氧化還原類。也可以按照其溶解性能分為水溶性引發劑(如無機類的過硫酸鹽、過氧化氫、水溶偶氮引發劑等)和油溶性(溶於單體或有機溶劑)的有機類引發劑。可以按照引發劑的分解方式將引發劑分為熱分解型和氧化還原分解型兩類。或者按照引發劑的使用溫度範圍,分為:①高溫(100℃以上)類,如烷基過氧化物、烷基過氧化氫物、過氧化酯等;②中溫 (40~100℃)類,如偶氮二異丁腈、過氧化二醯、過硫酸鹽等;③較低溫(0~40℃)類,如氧化還原引發體系。因此應根據聚合反應的溫度要求來選擇引發劑。如果高溫引發劑用在中溫範圍聚合,則分解速率過低,而使聚合時間延長;如果中溫引發劑用於高溫範圍聚合,則分解速率過快,引發劑過早消耗,在低聚合轉化率階段就停止反應。
偶氮化合物類
偶氮化合物是分子結構中含有偶氮基—N=N—並與兩個烷基(R,R')相連的化合物。通式為R—N=N—R',它可在光和熱作用下分解而放出氮氣、同時生成自由基。因此它是一類重要的聚合引發劑和發泡劑。許多偶氮化合物還是某些染料的中間體。一般可由重氮鹽和酚或芳香胺偶合而製得。
常用的有油溶性的偶氮二異丁腈、偶氮二異庚腈和偶氮二異丁酸二甲酯引發劑等,帶羧基、磺酸基等親水基團的偶氮化合物適用於水溶液聚合,水溶性的有偶氮二異丁基脒鹽酸鹽(V-50引發劑),適用於中溫引發分解反應。
過氧化物介紹
過氧化合物是含有過氧基(-O-O-)的一類化合物,受熱後-O-O-鍵斷裂,分裂成兩個相應的自由基,從而引發單體聚合,稱為過氧化物引發劑。分無機過氧化物和有機過氧物兩類。無機過氧化物引發劑,有過氧化氫、過硫酸銨或過硫酸鉀等,可溶於水,用作水溶液聚合、乳液聚合的引發劑;有機過氧化物引發劑,有過氧化苯甲醯、過氧化苯甲醯叔丁酯、過氧化甲乙酮等,可溶於甲苯、鄰苯二甲酸二甲酯、乙酸乙酯等有機溶劑中,是油溶性過氧化物,可引發不飽和聚酯的聚合、橡膠的硫化、氯乙烯、苯乙烯等烯類單體的聚合。而對於聚氯乙烯懸浮聚合幾乎唯一地採用有機過氧化物為引發劑。
有機過氧化物具有各種特性而有著不同的用途。最初僅用作漂白劑,發展至今已可用作不飽和聚酯的固化劑、生產合成樹脂如聚氯乙烯(PVC)、聚苯乙烯(PS)、低密度聚乙烯(LDPE)、聚醋酸乙烯(PVAC)和塗料用樹脂等的聚合引發劑,最近引人注目的是將有機過氧化物用作LDPE、乙烯—醋酸乙烯共聚物(EVA)、乙丙橡膠(EPM)和其他合成橡膠的交聯劑。此外,利用有機過氧化物的游離基反應性,還可通過聚丙烯(PP)分子鏈的斷裂降解而提高其流動性;也可通過PP、PS與馬來酸、丙烯酸酯的接枝而提高它們的粘接性、著色性;而用作鹵化反應引發劑則可製取有機原料等。
過氧化物的分解產物有可能通過許多途徑對聚合物產生直接的影響。例如,高能游離基從引發劑的分解產物中奪去氫,致使在聚合物鏈的游離基上或聚合物上會生成另外的游離基,有可能引起長鏈分支度的下降而產生交聯,或者由解聚作用使分子量下降,同時又提高了聚合物中單體基團的比例。
一般來講,有機過氧化物對熱不穩定,易分解,有的品種對衝擊和熱很敏感,在一定條件下會激烈地燃燒或爆燃,甚至有可能爆炸。而有的品種危險性實際上與普通溶劑近似。作為一種危險物品,有機過氧化物在其生產過程和使用過程的操作中,均發生了相當多的火災和爆炸事故。
離子型聚合引發劑
離子型聚合反應的特點是:①與自由基聚合相比,離子型聚合反應通常在較低溫度下進行。大多數聚合反應溫度低於0℃ ,而自由基聚合幾乎都在0℃以上甚至超過50℃的溫度下進行的。②離子型聚合反應的活化能總是小於相應的自由基聚合的活化能,甚至可能是負值。③離子型聚合對反應介質的極性和溶劑化能力的變化較敏感。在工業上的套用不如自由基聚合廣泛。④聚合反應不受自由基猝滅劑的加入而受影響。
陽離子聚合
與雙鍵相連的碳原子上有推電子取代基團(如烷基、烷氧基等)的烯類單體只能進行陽離子聚合,因該類取代基使雙鍵帶有一定的負電性而具親核性。所以當親電催化劑存在時,雙鍵打開,形成三價碳陽離子活性中心。
除乙烯類化合物外,醛類、環醚、環醯胺等類單體也可用陽離子催化劑進行聚合。陽離子反應所用的催化劑都是電子受體即親電試劑。常用的陽離子聚合催化劑有:①含氫酸。但其陰離子不應有很強的親核性,往往不採用氫鹵酸及強酸,如採用,聚合物分子量也不高。②路易斯酸如AlCl3、BF3、SnCl4、ZnCl2、TiCl4等,它被用作低溫下獲得高分子量聚合物的催化劑。在這類催化聚合體系中,除催化劑外,還須加入少量其他物質——質子給予體——水、有機酸及能產生碳陽離子的物質,使催化劑發揮作用。③其他陽離子聚合催化劑有I2、Cu2+、高能射線等。在陽離子聚合中,反應介質的特性起重要作用,反應介質的溶劑化能力增加,聚合速度和聚合度也增加;如採用介電常數較小的溶劑,除使聚合速度減小外,還能觀察到動力學級數的升高。
陰離子聚合
在該類反應中,烯類單體的取代基具有吸電子性,使雙鍵帶有一定的正電性,具有親電性,如:CH2=CH→CN、CH2=CH→NO2、CH2=CH→C6H5,凡電子給予體如鹼、鹼金屬及其氫化物、氨基化物、金屬有機化合物及其衍生物等都屬親核催化劑。陰離子聚合反應的引發過程不外有兩種形式:①催化劑分子中的負離子與單體形成陰離子活性中心;②鹼金屬把原子外層電子直接或間接轉移給單體,使單體成為游離:基陰離子陰離子聚合反應常常是在沒有鏈終止反應的情況下進行的。許多增長著的碳陰離子有顏色,如體系非常純淨,碳陰離子的顏色在整個聚合過程中會保持不變,直至單體消耗完。當重新加入單體時,反應可繼續進行,分子量也相應增加。這種在反應中形成的具有活性端基的大分子稱為活性聚合物。在沒有雜質的情況下,製備活性聚合物的可能性決定於單體和溶劑。如溶劑(液氨)和單體(丙烯腈)有明顯的鏈轉移作用,則很難得到活性聚合物。利用活性聚合物可製得嵌段共聚物、遙爪聚合物等。