定義
(1)累積雙烯。分子中兩個雙鍵連在同一個碳原子上。
(2)孤立雙烯。分子中兩個雙鍵被一個以上的
單鍵所隔開。
(3)共軛雙烯。分子中兩個雙鍵被一個單鍵所隔開。
分類
累積雙烯
累積雙烯也稱為“聚集二烯烴”或“連烯烴”,是
分子中含有一對相鄰
碳碳雙鍵(即有一個
碳原子通過兩個
雙鍵與相鄰兩個碳原子連線)的一類
雙烯。分子中具有超過一對相鄰碳碳雙鍵(累積雙鍵)的
烯烴則稱為“累積多烯烴”。最簡單的累積雙烯是丙二烯。相比其他烯烴,累積雙烯更加活潑,且可能具有手性。
丙二烯是最簡單的累積雙烯。
此類雙烯中,C-C-C鍵角為180°,兩個π鍵和四個取代基在空間上處於正交,中心碳原子為sp雜化。類似的正交π鍵出現在烯酮中。
特定的催化劑(如威爾金森催化劑)可使丙二烯的一個雙鍵被還原,另一個不受影響。
累積雙烯的合成方法有:由偕二鹵代環丙烷和有機鋰化合物發生Skattebø重排反應得到。由末端炔烴與甲醛、溴化銅和鹼反應得到。由某些二鹵化物的脫鹵化氫反應得到。
孤立雙烯
共軛雙烯
共軛雙烯是含有兩個碳碳雙鍵,並且兩個雙鍵被一個單鍵隔開,即含有體系(共軛體系)的雙烯。最簡單的共軛雙烯是
1,3-丁二烯。共軛雙烯相對於累積雙烯來說,更加穩定。
能以1,4-和1,2-兩種形式發生加成反應,還可發生雙烯合成反應(即Diels-Alder反應)及聚合反應等。可用合成的方法而製得。用於合成橡膠、溶劑,是重要的有機化工原料。
理化性質
共軛二烯烴的物理性質和烷烴、烯烴相似。碳原子數較少的二烯烴為氣體,例如1,3-丁二烯為沸點-4℃的氣體;碳原子數較多的二烯烴為液體,如異戊二烯為沸點34℃的液體。它們都不溶於水而溶於有機溶劑。
共軛二烯烴具有烯烴雙鍵的一些化學性質,但由於是共軛體系,在加成和聚合反應中,又具備一些特有的規律。共軛二烯烴含有共扼雙鍵,化學性質活潑,易發生均聚和共聚反應,也能與許多物質發生加成反應。
共軛雙烯化學反應
親電加成反應
1,2-加成和1,4-加成:極性試劑有利於1,4-加成;低溫有利於1,2-加成,高溫有利於1,4-加成。
共軛二烯烴同普通烯烴一樣,容易與鹵素、鹵化氫等親電試劑發生加成反應;它的特點是比普通烯烴更容易發生加成反應,但由於中間體變化,生成多種加成產物。共軛二烯的部分加成產物,即1,2-和1,4-加成產物,經歷不同的中間體,如1,3-丁二烯與HBr反應,生成相應的碳正離子。共軛二烯的結構是影響部分加成中間體的因素之一。因而,1,2-和1,4-加成產物的比例不僅受共軛二烯結構的影響,也隨反應條件,如溫度、溶劑和催化劑體系等的改變而改變;多數情況下,得到兩種反應產物。
電環化反應
電環化反應直鏈共軛多烯烴可發生分子內反應,
π鍵斷裂,
雙鍵兩端碳
原子以
σ鍵相連,形成一個環狀分子。電環化反應的顯著特點是高度的
立體專一性,即在一定條件下(光或熱)生成特定構型的產物。
電環化反應是周環反應的一種類型,所謂周環反應是指在化學反應過程中能形成環狀過渡態的一些協同反應,它不受溶劑極性的影響,也不受催化劑和引發劑的影響,反應條件為加熱或光照 。在整個反應過程中,不產生任何活性中間體。反應中有兩個或更多的鍵,同時破裂和生成。即以協同的方式進行。Woodward Hoffmann 於 1965 年提出了電環化反應選擇規則, 一般教科書都以π電子數和反應條件的關係來表示該規則。對於含偶數碳原子的共軛多烯,一般都以中性分子的形式形成共軛體系,這類多烯含有的 π電子數正好等於所含碳原子數 。如:丁二烯,所含碳原子數和 π電子數都是 4 個, 即可歸為 4n 個 π電子體系(n =1 , 2 , 3 ……)。而己三烯所含碳原子數和π電子數都是 6 個,可歸為 4n +2 個 π電子體系 。(n =0 , 1 , 2 , 3 ……)所以這類多烯的電環化反應學生易於掌握。但對於含奇數個碳原子的多烯,一般以帶電離子的形式形成共軛體系,這種離子的 π電子數和所含碳原子數不再相等,學生對這類多烯的電環化反應感到難以理解 。因此在教學中擬採用以下方法對含奇數個碳原子的共軛多烯體系的電環化反應選擇規則進行分析講解。首先把這類多烯分成 4n +1 和 4n -1(n =1, 2 , 3……)個碳原子兩種類型,然後具體地分析這兩種類型的正負離子。4n +1 個碳原子的正離子,如:戊二烯基正離子含 5 個碳原子(n =1),4 個π電子,可歸為 4n 個π電子體系;4n -1個碳原子的負離子,如:烯丙基負離子,含有 3 個碳原子(n =1),4 個π電子,亦可歸為 4n 個 π電子體系,即4n +1 個碳原子的正離子和 4n -1 個碳原子的負離子都可屬於 4n 個π電子體系。而 4n +1 個碳原子的負離子,如:戊二烯基負離子含 5 個碳原子(n =1),6 個 π電子,可歸為 4n +2 個 π電子體系;4n -1 個碳原子的正離子,如:烯丙基正離子含 3 個碳原子(n =1),2 個 π電子,可歸為 4n +2 個 π電子體系,即 4n +1 個碳原子的負離子和 4n -1 個碳原子的正離子都屬於 4n+2 個π電子體系。
聚合反應
如1,3-丁二烯(CH2=CH-CH=CH2)聚合生成-[-CH2-CH=CH-CH2-]n-
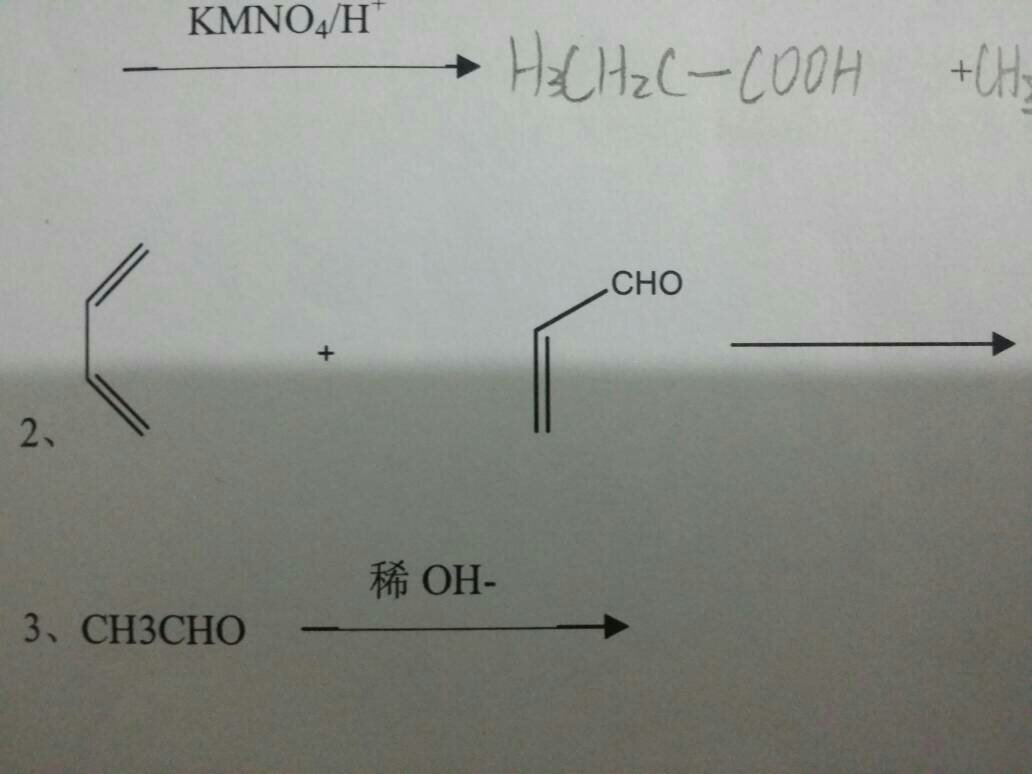
雙烯合成
又稱狄爾斯-阿爾德(Diels-Alder反應)。共軛二烯烴和某些具有碳碳雙鍵、三鍵的不飽和化合物進行1,4一加成,生成環狀化合物的反應稱為雙烯合成反應。
狄爾斯一阿爾德反應是協同反應,即舊鍵的斷裂和新鍵的形成是相互協調地在同一步驟中完成的。在光照或加熱的條件下,反應物分子彼此靠近,互相作用,形成一個環狀過渡態,沒有活潑中間體如碳正離子、碳負離子和自由基的產生,然後逐漸轉化為產物分子。
(1)雙烯體(共軛二烯)是以s一順式構象進行反應的,雙烯體可以是鏈狀,也可以是環狀。
(2)親雙烯體的雙鍵碳原子上連有拉電子基團時,反應易進行。常見的親雙烯體有:
CH2=CH-CHO、CH2=CH-COOH、CH2=CH—COCH3、CH2=CH-NO2、CH2=CH—CN、
CH2-CH-COOCH3。
(3)狄爾斯一阿爾德反應具有很強的區域選擇性。當雙烯體與親雙烯體均有取代基時,兩個取代基處於鄰位或對位的產物占優勢。當雙烯體1號位有推電子基,親雙烯體上有拉電子基時,產物以兩取代基處在鄰位為主;當雙烯體2號位有推電子基,親雙烯體上有拉電子基時,產物以兩取代基處在1,4位為主。
(4)狄爾斯一阿德爾反應是一個可逆反應。通常正向成環反應的反應溫度相對較低,提高反應溫度則發生逆向的分解反應。利用這種可逆性,既可以作為提純雙烯化合物的一種方法,也可以用來製備少量不易保存的雙烯體,例如,實驗室少量使用1,3一丁二烯時可用環己烯加熱分解來製備。此外,可利用其逆反應分離有機物以及有機反應基團的保護等。
(5)狄爾斯一阿德爾反應的產量高,套用範圍廣是現代有機合成反應中非常重要的碳碳鍵形成的方法,在理論和生產上都占有重要的地位。