Diels-Alder反應為可逆反應。有些Diels-Alder反應加成物在發生可逆時會產生2種可能的情況:一是在一定條件下可逆為原來的雙烯體和親雙烯體;一是在另一條件下生成新的雙烯體和新的親雙烯體。逆Diels-Alder反應在有機化學特別是有機合成中有著廣泛而巧妙的套用。
基本介紹
- 中文名:逆第爾斯阿爾德反應
- 外文名:retro-Diels-Alder reaction
- 別名:逆狄爾斯-阿爾德反應
重要的相關知識,定義,重要套用,
重要的相關知識
狄爾斯-阿爾德反應
Diels-Alder reaction,是一種有機反應(具體而言是一種環加成反應)。共軛雙烯與取代烯烴(一般稱為親雙烯體)反應生成取代環己烯。即使新形成的環之中的一些原子不是碳原子,這個反應也可以繼續進行。一些此類反應是可逆的,這樣的環分解反應叫做逆狄爾斯-阿爾德反應或逆Diels-Alder反應(retro-Diels-Alder reaction)。1928年德國化學家奧托·迪爾斯和他的學生庫爾特·阿爾德首次發現和記載這種新型反應,他們也因此獲得1950年的諾貝爾化學獎。狄爾斯-阿爾德反應(Diels-Alder反應,又譯作第爾斯-阿爾德等),又名雙烯加成,由共軛雙烯與烯烴或炔烴反應生成六元環的反應,是有機化學合成反應中非常重要的形成碳碳鍵的手段之一,也是現代有機合成里常用的反應之一。該反應有豐富的立體化學呈現,兼有立體選擇性、立體專一性和區域選擇性等。
當雙烯和親雙烯體兩者都有適當的取代基,使反應可能發生不同區位而得到兩種產物時,事實上只有一種是主要的。例如異戊二烯與丁烯酮反應,以得到甲基-(4-甲基-3-環己烯基)甲酮為主: 在立體化學方面,這類反應都是順式加成的,而且當反應物有可能生成內型和外型兩種產物時,一般只得內型化合物,例如環戊二烯與順丁烯二酐的反應。這些立體選擇性不但符合大量的實驗事實,而且在理論上也能用分子軌道對稱守恆原理加以解釋。
定義
Diels-Alder反應為可逆反應。有些Diels-Alder反應加成物在發生可逆時會產生2種可能的情況:一是在一定條件下可逆為原來的雙烯體和親雙烯體;一是在另一條件下生成新的雙烯體和新的親雙烯體。
重要套用
逆Diels-Alder反應在有機化學特別是有機合成中有著廣泛而巧妙的套用,從3方面歸納概述如下:
(1)保護基團
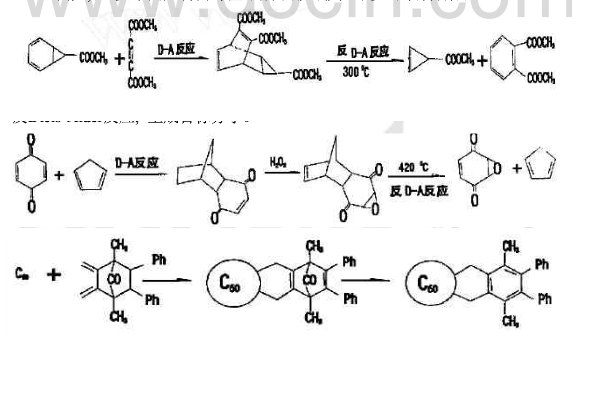
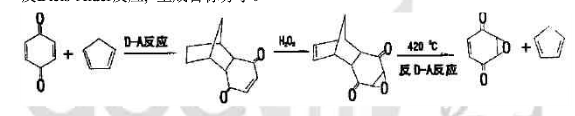
環氧苯醌的合成,無法由苯醒直接氧化進行。可利用環戊二烯作為雙烯體將苯醌中的一個雙鍵保護起來,然後再用過氧化氫氧化另一雙鍵,最後在髙溫下發生逆Diels-Alder反應,生成目標分子。
(2)複雜化合物合成簡單化
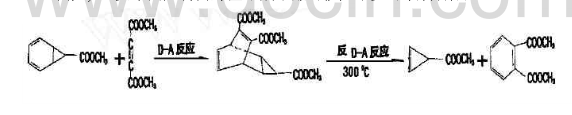
在有機合成中 ,有些化合物很難用一般方法進行合成 ,若巧妙地運用Diels-Alder反應和逆Diels-Alder反應進行設計,則可以實現。例如,重要中間產物丙烯某甲酸甲酯可按如下步驟順利合成:
(3)鑑別有機物
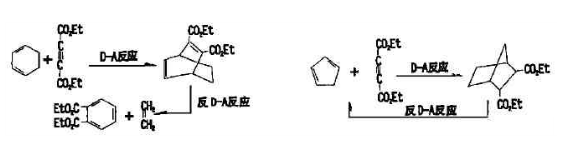
具有環己二烯結構的化合物與丁炔乙酸乙酯發生Diels-Alder反應得到的加成物,經過另一溫度下的逆Diels-Alder反應,則生成新的親雙烯體乙烯和新的雙烯體鄰苯二甲酸二乙酯(芳香族化合物,極易鑑別)。而環戊二烯經上述過程不能得到芳香族化合物。據此,可鑑別出具有環己二烯結構的化六物。
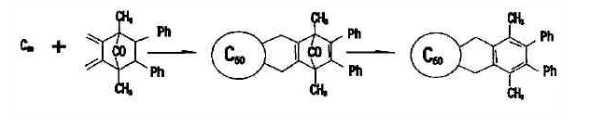
(4) 的Diels-Alder反應
的Diels-Alder反應

向從1985年Kroto和Smalley從質譜中確實 的存在,及1990年Kratchmer等在He氣氛下用電弧法製得克量級的
的存在,及1990年Kratchmer等在He氣氛下用電弧法製得克量級的 後,由於
後,由於 富勒烯獨特的電子結構和物理化學性成,引起科學家的普遍關注。尤其是富勒烯的化學可修飾性及其本身和衍生物潛在的套用前景,更使
富勒烯獨特的電子結構和物理化學性成,引起科學家的普遍關注。尤其是富勒烯的化學可修飾性及其本身和衍生物潛在的套用前景,更使 研究空前活躍。氧化反應、還原反應、自由基反應、電荷轉移複合物的製備和加成反應,特別是環加成反應已成為
研究空前活躍。氧化反應、還原反應、自由基反應、電荷轉移複合物的製備和加成反應,特別是環加成反應已成為 化學修飾的強有力工具。
化學修飾的強有力工具。 的缺電子特徵,使其成為一個很好的Diels-Alder反應的親烯體 ,再與一系列雙烯體進行加成反應,對於
的缺電子特徵,使其成為一個很好的Diels-Alder反應的親烯體 ,再與一系列雙烯體進行加成反應,對於 富勒烯衍生物的製備是一個非常顯著有效的方法。Dids-Alder環加成反應優先發生在球稀六元環和六元環共用的邊。一些例子說明,由於加成產物的低溫穩定性,使Diels-Alder反應易於進行,而非常穩定的加成產物己經被制出。
富勒烯衍生物的製備是一個非常顯著有效的方法。Dids-Alder環加成反應優先發生在球稀六元環和六元環共用的邊。一些例子說明,由於加成產物的低溫穩定性,使Diels-Alder反應易於進行,而非常穩定的加成產物己經被制出。