理化性質,用途,製備,工業製法,實驗室製法,注意事項,使用限量,製取氧氣,實驗原理,實驗藥品,實驗步驟,化學實驗,實驗目的,實驗內容,實驗注意,毒理資料,急性毒性,致突變性,致癌性,危險特性,健康危害,環境數據,防護措施,泄漏處理,急救措施,危險行為,法規信息,相關術語,安全術語,風險術語,常見謠言,
理化性質
簡介
毒害物質數據:7722-84-1(Hazardous Substances Data)
職業標準:
TWA1.4毫克/立方米;STEL4.2毫克/立方米
國中實驗室製取氧氣的方法:
反應物:過氧化氫
反應條件:二氧化錳(土豆塊,紅磚粉末)等——催化劑(加快過氧化氫的分解速率)
生成物:氧氣和水
物理性質
純過氧化氫是淡藍色的粘稠液體,熔點-0.43 °C,沸點150.2 °C,純的過氧化氫其分子構型會改變,所以熔沸點也會發生變化。凝固點時固體密度為1.71g/cm
3,
密度隨溫度升高而減小。它的締合程度比H
2O大,所以它的
介電常數和沸點比水高。
化學性質
1.氧化性
原理:硫化鉛→氧化鉛→鹼式碳酸鉛
(需要鹼性介質)
2.
還原性 和氯氣、高錳酸鉀等強氧化劑反應被氧化生成氧氣。
3.在10%試樣液10mL中,加
稀硫酸試液(TS-241)5mL和高錳酸鉀試液(TS-193)1mL。應有氣泡發生,且高錳酸鉀的紫紅色消失。對石蕊呈酸性。遇有機物易爆。
4.取試樣1g(準確至0.1mg),用水稀釋至250.0mL。取此溶液25mL,加10mL稀硫酸試液(TS-241)後用0.1mol/L高錳酸鉀滴定。每毫升0.1mol/L。高錳酸鉀相當於過氧化氫(H2O2)1.70mg。
6..過氧化氫是一種極弱的酸:H2O2 =(可逆)=H++HO2-(Ka=2.4×10-12)。因此金屬的過氧化物可以看做是它的鹽。
7.純過氧化氫很不穩定,加熱到153 °C便猛烈的分解為水和氧氣。
用途
雙氧水的用途分醫用、軍用和工業用三種,日常消毒的是
醫用雙氧水,醫用雙氧水可殺滅腸道致病菌、化膿性球菌,致病酵母菌,一般用於物體表面消毒。 雙氧水具有
氧化作用,但醫用雙氧水濃度等於或低於3%,擦拭到創傷面,會有灼燒感、表面被氧化成白色並冒氣泡,用清水清洗一下就可以了,過3—5分鐘就恢復原來的膚色。
 過氧化氫漂白機理
過氧化氫漂白機理 化學工業用作生產
過硼酸鈉、
過碳酸鈉、
過氧乙酸、
亞氯酸鈉、過氧化硫脲等的原料,酒石酸、維生素等的氧化劑。醫藥工業用作殺菌劑、消毒劑,以及生產福美雙殺蟲劑和40l抗菌劑的氧化劑。印染工業用作棉織物的漂白劑,還原染料染色後的發色。用於生產金屬鹽類或其他化合物時除去鐵及其他重金屬。也用於
電鍍液,可除去無機雜質,提高鍍件質量。還用於羊毛、生絲、象牙、紙漿、脂肪等的漂白。高濃度的過氧化氫可用作火箭動力助燃劑。
民用:處理廚房下水道的異味,到藥店購買雙氧水加水加洗衣粉倒進下水道可去污,消毒,殺菌;
3%的過氧化氫(醫用級)可供傷口消毒;
製備
工業製法
鹼性過
氧化氫製法:生產鹼性過氧化氫用含醌空氣電極,其特徵在於每對電極由
陽極板、
塑膠網、
陽離子隔膜和含醌空氣陰極組成,在電極工作區的上、下端設有進入流體的分配室和排出流體的收集室,在流體進口處設有節流孔,多組元電極採用有限制的偶極串聯接法,加長陽極循環鹼水進、出口用的塑膠軟管後再接至集液總管,多組元電極組由單元極板組裝。
磷酸中和法:其特徵在於,用下列步驟從過氧化鈉水溶液製備:
⑴用磷酸或
磷酸二氫鈉NaH
2PO
4將氫氧化鈉溶液中和至pH8.0~8.7,使生成NaH2PO
4和H
2O
2的水溶液。
⑵使所說的Na
2HPO
4和
H2O2水溶液冷卻到+5~-5℃,從而使絕大部分NaH2PO
4以NaH2PO
4·110H
2O水合物形式析出。
⑶在
離心分離器中對含有NaH
2PO
4 ·10H
2O水合物和過氧化氫水溶液混合物進行分離,從而使NaH
2PO
4 ·110H
2O結晶從含少量NaH
2PO
4和過氧化氫水溶液中分離出來。
⑷將所說的含少量NaH
2PO
4和過氧化氫水溶液在
蒸發器中蒸發,得到含H
2O
2和H
2O的蒸汽,而含過氧化氫的NaH
2PO
4的濃
鹽溶液從底部流出並返回中和槽。
⑸將所說的含H
2O
2和
H2O的蒸汽在
分餾塔中進行減壓
分餾,得到約30%H
2O
2產品。
電解硫酸法:用電解60%的硫酸,得到
過二硫酸,再經水解可得濃度為95%的雙氧水。
2-乙基蒽醌法:工業規模化生產主要方法是
2-乙基蒽醌(EAQ)法。2-乙基蒽醌在一定溫度壓力在催化劑作用下和氫氣反應生成2-乙基氫蒽醌,2-乙基氫蒽醌在一定溫度壓力下與氧發生
氧化還原反應,2-乙基氫蒽醌還原生成2-乙基蒽醌同時生成過氧化氫,再經過萃取獲得過氧化氫水溶液,最後經過重芳烴淨化得到合格的過氧化氫水溶液,俗稱
雙氧水,此工藝大多用來製備27.5%的雙氧水,濃度較高的過氧化氫水溶液(如35%、50%的雙氧水)則可以通過蒸餾得到。
實驗室製法
一:
於100ml15-18%的硫酸中,在凍的冷卻下,逐漸加入
過氧化鋇,加入的量以保持溶液的弱酸性為度(約40g)。傾出上層溶液即得到過
氧化氫溶液。必要時可進行提取。每次用20ml提取4-5次。將醚提取物置於水浴上蒸發(不要高於40℃)除去醚,將剩餘物移至硫酸保乾瓶中。用此法可以製得50%過氧化氫溶液。
二:
將90g過氧化鈉在強烈攪拌下分次少量地加入用冰水冷卻的800ml20%的硫酸中,應保持溫度不高於15℃。放置12小時,濾去析出的
十水硫酸鈉結晶。將濾液置於磨口真空裝置中(5-10mm),在浴溫60-65攝氏度(最後在85℃)下進行蒸餾,每次的蒸餾量為100ml。用兩個串聯的受器
(第二個受器套用冰冷卻)收集餾出物,第一個受器中的產品含過氧化氫含量高於20%,第二個受器含過
氧化氫3%以下。所得過氧化氫溶液進一步濃縮可在濃硫酸真空保乾器中,於室溫下進行,經三天后即可將25%的溶液濃縮至88%。
過氧化氫稀溶液也可以用凍結法使水凝結而達到濃縮的目的。
注意事項
1、不得口服,應置於兒童不易觸及處。
2、對金屬有腐蝕作用,慎用。
3、避免與鹼性及氧化性物質混合。
4、避光、避熱,置於常溫下保存。
5、醫用的有效期一般為2個月。
6、不得用手觸摸。
使用限量
GB 2760-86:生牛乳保鮮與
硫氰酸鈉配合使用,限量為0.03%過氧化氫2.0ml/L加硫氰酸鈉15.0ml/L。限黑龍江、內蒙地區使用,擴大使用地區時須由所在省級衛生部門報請衛生部批准並按農業部有關實施規範執行。袋裝豆腐乾.0.86g/L(殘留量不得檢出)。
FDA,§184.1.366(2000):制乾酪用牛乳,0.05%;
電解法乳清製造0.05%;澱粉防腐用0.15%;玉米糖漿還原S02用,0.15%;染色的乾酪乳清還原用,0.05%;
脂肪酸酯類
乳化劑漂白用,1.25%。用後均應除去,不得殘留。
食品添加劑最大允許使用量最大允許殘留量標準:過氧化氫為食品工業用加工助劑,一般應在製成最後成品之前除去,有規定食品中殘留量的除外。
製取氧氣
實驗原理
MnO2
2H2O2==2H2O+O2↑
實驗藥品
3%過氧化氫溶液、小木條、二氧化錳固體
實驗步驟
在試管中加入少量過氧化氫溶液,把帶火星的小木條放在試管口,觀察現象(無明顯現象)
在試管中加入少量二氧化錳,觀察現象(出現大量氣泡,木條復燃)
當停止生成氣泡時,繼續加入過氧化氫溶液,觀察現象(出現大量氣泡,木條復燃)
化學方程式:
化學實驗
用高錳酸鉀測定過氧化氫的濃度
實驗目的
實驗內容
實驗原理
H2O2是醫藥、衛生行業上廣泛使用的
消毒劑,它在酸性溶液中能被KMnO
4定量氧化而生成氧氣和水,其反應如下:
滴定在酸性溶液中進行,反應時錳的
氧化數由+7變到+2。開始時反應速度慢,滴入的
KMnO4溶液褪色緩慢,待Mn2+生成後,由於Mn2+的
催化作用加快了反應速度。
生物化學中,也常利用此法間接測定過氧化氫酶的活性。在血液中加入一定量的H
2O
2,由於
過氧化氫酶能使過氧化氫分解,作用完後,在酸性條件下用標準KMnO
4溶液滴定剩餘的H
2O
2,就可以了解酶的活性。
儀器試劑
台秤(0.1g)或天平(0.1mg),試劑瓶(棕色),
酸式滴定管(棕色,50cm3),
錐形瓶(250cm3),
移液管(10cm3、25cm3);H
2SO
4(3 mol/L), KMnO4(s),Na2C2O4(s,AR.),
雙氧水樣品(工業)。
實驗步驟
1)KMnO4溶液(0.02 mol/L)的配製
稱取1.7g 左右的KMnO
4放入
燒杯中,加水500cm3,使其溶解後,轉入棕色試劑瓶中。放置7-10天后,用玻璃砂芯漏斗過濾。殘渣和沉澱則倒掉。把試劑瓶洗淨,將濾液倒回瓶內,待標定。
2)KMnO4溶液的標定
精確稱取0.15~0.20g預先乾燥過的Na
2C
2O
4三份,分別置於250cm3錐形瓶中,各加入40cm3
蒸餾水和10cm33 mol·dm-3 H2SO4,水浴上加熱直約75-85℃。趁熱用待標定的KMnO
4溶液進行滴定,開始時,滴定速度宜慢,在第一滴KMnO4溶液滴入後,不斷搖動溶液,當紫紅色退去後再滴入第二滴。溶液中有Mn2+產生後,滴定速度可適當加快,近終點時,紫紅色褪去很慢,應減慢滴定速度,同時充分搖動溶液。當溶液呈現微紅色並在半分鐘不褪色,即為終點。計算KMnO4溶液的濃度。滴定過程要保持溫度不低於60℃。
3)H2O2含量的測定:
用移液管吸取5.00cm3 雙氧水樣品(H2O2含量約5%),置於250cm3容量瓶中,加水稀釋至標線,混合均勻。
吸取25cm3上述稀釋液三份,分別置於三個250cm3錐形瓶中,各加入5cm33 mol·dm-3 H2SO4,用KMnO4標準溶液滴定之。計算樣品中H2O2的含量。
實驗注意
1. KMnO4溶液在加熱及放置時,均應蓋上表面皿。
2. KMnO4作為氧化劑通常是在H2SO4酸性溶液中進行,不能用HNO3或HCl來控制酸度。在滴定過程中如果發現棕色混濁,這是酸度不足引起的,應立即加入濃H2SO4,如已達到終點,應重做實驗。
3. 標定KMnO
4溶液濃度時,加熱可使反應加快,但不應熱至沸騰,因為過熱會引起
草酸分解,適宜的溫度為75℃~85℃。在滴定到終點時溶液的溫度應不低於60℃。
4. 開始滴定時反應速度較慢,所以要緩慢滴加,待溶液中產生了Mn2+後,由於Mn2+對反應的催化作用,使反應速度加快,這時滴定速度可加快;但注意不能過快,近終點時更須小心地緩慢滴入。
毒理資料
急性毒性
LD50 4060mg/kg(大鼠經皮);LC50 2000mg/m3,4小時(大鼠吸入)
致突變性
微生物致突變:
鼠傷寒沙門氏菌
10μL/皿;大腸桿菌5ppm。姊妹染色單體交換:倉鼠肺353μmol/L。
致癌性
IARC 致癌性評論:動物可疑陽性。
危險特性
爆炸性強氧化劑。過氧化氫自身不燃,但能與可燃物反應放出大量熱量和氧氣而引起著火爆炸。過氧化氫在pH值為 3.5~4.5時最穩定,在鹼性溶液中極易分解,在遇強光,特別是短波射線照射時也能發生分解。當加熱到100℃以上時,開始急劇分解。它與許多有機物如糖、澱粉、醇類、石油產品等形成
爆炸性混合物,在撞擊、受熱或電火花作用下能發生爆炸。過氧化氫與許多
無機化合物或雜質接觸後會迅速分解而導致爆炸,放出大量的熱量、氧和水蒸氣。大多數
重金屬(如銅、銀、鉛、汞、鋅、鈷、鎳、鉻、錳等)及其氧化物和鹽類都是活性催化劑,塵土、香菸灰、碳粉、鐵鏽等也能加速分解。濃度超過69%的過氧化氫,在具有適當的點火源或溫度的密閉容器中,會產生氣相爆炸。
健康危害
侵入途徑:皮膚接觸、吸入、食入。
健康危害:高濃度過氧化氫有強烈的腐蝕性。吸入該品蒸氣或霧對呼吸道有強烈刺激性。眼直接接觸液體可致不可逆損傷甚至失明。口服中毒出現腹痛、胸口痛、呼吸困難、嘔吐、一時性運動和感覺障礙、體溫升高等。個別病例出現視力障礙、癲癇樣痙攣、輕癱。
環境數據
該物質對水生生物是有毒的。
防護措施
呼吸系統防護:可能接觸其蒸氣時,應該佩戴自吸
過濾式防毒面具(全面罩)。
眼睛防護:呼吸系統防護中已作防護。
其它:工作現場嚴禁吸菸。工作畢,淋浴更衣。注意個人清潔衛生。
泄漏處理
迅速撤離泄漏污染人員至安全區,並進行隔離,嚴格限制出入。建議應急處理人員戴自給
正壓式呼吸器,穿
防酸鹼工作服。儘可能切斷泄漏源,防止進入下水道、排洪溝等限制性空間。小量泄漏:用砂土、
蛭石或其它惰性材料吸收。也可以用大量水沖洗,洗水稀釋後放入廢水系統。大量泄漏:構築圍堤或挖坑收容;噴霧狀水冷卻和稀釋蒸汽、保護現場人員、把泄漏物稀釋成不燃物。用泵轉移至槽車或專用收集器內,回收或到家至廢物處理場所處置。
廢棄物處置方法:廢液經水稀釋後發生分解,放出氧氣,待充分分解後,把廢液沖入下水道。
急救措施
皮膚接觸:脫去被污染的衣著,用大量流動清水沖洗。
眼睛接觸:立即提起眼瞼,用大量流動清水或生理鹽水徹底沖洗至少15分鐘。就醫。
吸入:迅速脫離現場至空氣新鮮處。保持呼吸道通暢。如呼吸困難,給輸氧。如呼吸停止,立即進行人工呼吸。就醫。
食入:飲足量溫水,催吐,就醫。
滅火方法:消防人員必須穿戴全身防火
防毒服。儘可能將容器從火場移至空曠處。噴水冷卻火場容器,直至滅火結束。處在火場中的容器若已變色或從安全泄壓裝置中產生聲音,必須馬上撤離。滅火劑:水、霧狀水、乾粉、砂土。
包裝注意事項:大包裝:塑膠桶(罐),容器上部應有減壓閥或通氣口,容器內至少有10%餘量,每桶(罐)淨重不超過50公斤。試劑包裝:塑膠瓶,再單個裝入塑膠袋內,合裝在鈣塑箱內。
危險行為
萬一誤飲或以雙氧水
灌腸,可能導致口腔或消化道的黏膜受侵蝕而導致發炎,嚴重時可能穿孔或出血。
注射雙氧水,將導致血栓,容易導致器官壞死,嚴重者可能會有生命危險。
一般的食品加工禁止使用雙氧水。
法規信息
相關術語
安全術語
S26In case of contact with eyes, rinse immediately with plenty of water and seek medical advice.
 過氧化氫
過氧化氫不慎與眼睛接觸後,請立即用大量清水沖洗並徵求醫生意見。
S36/37/39Wear suitable protective clothing, gloves and eye/face protection.
穿戴適當的防護服、手套和護目鏡或面具。
S45In case of accident or if you feel unwell, seek medical advice immediately (show the label whenever possible.)
若發生事故或感不適,立即就醫(可能的話,出示其
標籤)。
風險術語
R22Harmful if swallowed.
吞食有害。
R41Risk of serious damage to the eyes.
對眼睛有很嚴重的傷害。
常見謠言
謠言:在做過氧化氫溶液制氧氣的實驗中誤將高錳酸鉀當成二氧化錳跟其混合,其結果是:反應速率和生成氧氣的量和沒有加高錳酸鉀時一樣
上述“習題”出自2013-2014學年江蘇省鹽城市東台市四灶鎮中學九年級(上)月考化學試卷(1月份)第11題
駁斥:高錳酸鉀可以直接與過氧化氫反應:2KMnO4+3H2O2====2KOH + 2MnO2↓ + 2H2O + 3O2↑(鹼性或中性環境),正確的實驗現象是:劇烈反應,釋放的氧氣量增加。從化學方程式中可以看出,3個H2O2生成3個O2,也就是氧氣是完全由H2O2產生的,與高錳酸鉀無關,但比自行分解出的O2要多。高錳酸鉀作為氧化劑參與反應中,影響了氧氣釋放量。
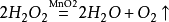
 過氧化氫漂白機理
過氧化氫漂白機理
 過氧化氫
過氧化氫