基本信息
雌激素受體包括兩大類:一是經典的
核受體,包括ERα和ERβ,它們位於細胞核內,介導雌激素的基因型效應,即通過調節特異性靶基因的轉錄而發揮“
基因型”調節效應;二是膜性受體,包括經典核受體的膜性成分以及屬於G蛋白
偶聯受體家族的GPER1(GPR30)、Gaq-ER和ER-X ,它們介導快速的非基因型效應,通過
第二信使系統發揮間接的轉錄調控功能,其中一些似乎只在腦局部起作用。這兩類受體在機體內的分布具有組織/細胞
特異性,參與了對諸如生殖、學習、記憶、認知等多種功能的調節。
近年研究就發現經典雌激素受體也可位於細胞膜或細胞漿,雌激素與其結合後啟動第二信使系統。雌激素在人體介導了很多生物學效應,而最初人們認為它的功能只受核受體的調控,即雌激素以自由擴散形式通過質膜,並與核受體緊密結合,通過結合靶基因上的雌激素
應答元件(estrogen response element, ERE)調節基因表達或與其他核蛋白相互作用以改變基因的轉錄活性。近年的研究還發現了很多可介導快速
非基因效應的膜性雌激素受體,如G蛋白
偶聯雌激素受體1(G protein-coupled estrogen receptor 1,GPER1)又叫G蛋白偶聯受體30(G protein-coupled receptor 30,GPR30)、Gaq-ER 和ER-X,經典
核受體也具有膜性成分。本文就雌激素兩種受體的結構、信號轉導途徑及其組織分布作一綜述。
結構
雌激素核受體
即經典的雌激素受體,包括ERα、ERβ兩種亞型,二者的結構相似,有A、B、C、D、E、F、J幾個區域。A/ B區具有一個非配體依賴的的
轉錄激活區(ligand independent activation function 1,AF-1),該功能區不依賴配體即雌激素的激活,可能參與了調節雌激素與受體的結合以調節雌激素應答
基因的轉錄。C區稱為DNA結合域(DNA binding domain,DBD),兩種受體此區域基本一樣,含有相同的
外顯子。該區含有一個雙
鋅指結構,兩個鋅指結構協同作用,共同調節此區域與特異DNA的結合,以達到轉錄靶基因的目的。D 區的作用是結合DNA,有時還會影響
受體蛋白質的DNA結合位點的結構(另有維基百科指出D區的作用是作為C區和E區的鉸合)。E/F 區稱為
配體結合域(ligand binding domain,LBD)。E區作用最多,例如與雌激素的結合、受體二聚化、核定位及與輔助
激活因子或輔助抑制因子的結合等。同時E區還包含有另外一個依賴配體的
轉錄激活區(ligand-dependent activation function 2,AF-2),AF-2遇到不同的雌激素會呈現出不同的構像,並決定轉錄靶基因所需要結合的輔助激活因子和輔助抑制因子。ERβ的AF-1功能微弱而AF-2與ERα的AF-2相似,提示它們在轉錄水平對不同的雌激素反應性基因作用不同,即轉錄基因需要AF-1和AF-2時ERβ的功能較ERα弱;在不需要AF-1 時兩種ER的功能相當。AF-1與AF-2 的相互配合,能夠使轉錄因子獲得最大的轉錄活性。當DBD與DNA結合後,AF-1即可激活DNA的轉錄活性,AF-2與LBD相重疊,當AF-2區與雌激素結合後,即可激活DNA的轉錄。F區功能尚不明朗。D/E/F統稱為配體結合區,兩種亞型雌激素受體此區只有53%的相同胺基酸序列,因此兩種受體既有共同的配體,也有各自不同的配體。
雌激素的膜性受體
核受體型 指經典的
核受體也可見於細胞膜,故稱核受體型膜受體。早在1977年,Pietras等發現雌激素可以通過細胞膜結合位點快速上調子宮內膜細胞cAMP水平,因而推測存在胞膜性ER(membrane estrogen receptor,mER)。1995年Pappas等首次證實質膜上存在ERα,可以與針對核受體不同
結構域的各種抗體相互作用,提示兩種受體結構極為相似。越來越多的證據認為經典的ERα可以定位於胞膜,作為膜性雌激素受體,表達於MCF-7人乳腺癌細胞膜,Song等運用雷射
共聚焦發現在雌二醇(E2)刺激下,經典的ERα轉位至細胞膜。Razandi等在CHO細胞中發現ERα和ERβ除了在細胞內表達外,細胞膜上也有分布。與
細胞內受體相比,膜性受體只占2%~3%。
核受體類似型 意即與核受體結構類似但不完全相同的膜性受體。用針對ERα不同結構域的多種抗體, 發現在子宮中存在5種分子量不同的蛋白質。因此,有理由認為存在膜性ER,它們雖然與核ER有關,但結構有差別。所有這些雌激素結合蛋白可能來自核受體不同的剪下方式。這就使它們可以插入跨膜區,保存核受體的配體結合
結構域,丟棄DNA結合結構域和其他部分,從而產生多種
膜受體,如ERα的
變異體ER-46。
膜性受體GPER1 GPER1也叫GPR30,是真正意義上的膜性受體,為一類由375個
胺基酸殘基組成的7 次跨膜的G蛋白偶聯受體(G protein-coupledreceptor,GPCR)。Bologa等發現了一種非固醇類化合物G-1,它與ERα和ERβ的親和力非常低,而與GPR30親和力卻是雌激素的近兩倍,因此被廣泛用於研究GPR30的生物效應中,也因此被國際藥理學聯合會(IUPHAR IUP)命名為GPER1。目前關於GPER1亞細胞位點的學說仍存在爭議。傳統理論認為,GPCR
配體結合位點均位於細胞外表面,但現已證實,當其配體為脂溶性時,GPCR亦可在細胞質內或核內結合配體產生功能。在不同組織來源的細胞中,GPER1與配體結合時均具有高親和力、高異性、可置換性等
膜受體的特性,同時,RT-PCR和
免疫細胞化學檢測所得的結果也提示其主要位於細胞膜上。雌激素可自由通過胞膜的特性使GPER1亦有位於細胞內的可能,Revankar等將
綠色螢光蛋白(GFP)與GPER1結合,並使用各種亞
細胞結構標記物作為定位對照,在共聚焦螢光顯微鏡下發現GPER1-GFP複合體主要沉積於細胞內質網上,Ga
亞基與Gbg亞基結合,提供GPER1啟動的必要信號,在適當的條件下,胞內GPER1可能向
細胞表面易位。Sakmoto等用細胞內
細胞器標記物和
免疫電鏡等特殊標記顯示GPER1主要定位於神經元的高爾基複合體而非細胞表面。我們的工作發現GPER1主要位於海馬
錐體細胞胞漿內的膜性結構如
粗面內質網,也見於細胞膜和
線粒體。造成這種差異的原因可能是各實驗室所用抗體的不同、或者細胞的狀態不同等。
其他類型 新近發現的膜性受體還包括ER-X和Gaq-ER。ER-X不同於經典的核受體,也不是核受體的
變異體,它與ERα有相同的C區域,但它不是ERα的剪下體,可能是一種新的
基因。Paech等發現高表達的ER-X見於野生型與ERα
基因敲除鼠、轉基因AD模型鼠生後1~7天而非成年的
新皮質、下丘腦、小腦,缺血性腦損傷或可以誘導其表達。它可能具有引導腦
自分泌和旁分泌的功能,有保護神經元的作用。Qiu等用全細胞記錄方法在敲除GPER1豚鼠的弓狀核中發現了一種依賴Gaq蛋白的膜性受體,它不同於其他膜性受體而是一種調節GABAB受體去敏感化的ER,主要通過Gaq蛋白激活
磷脂酶C介導向上的蛋白激酶、調控
蛋白激酶A,並最終改變基因的轉錄活性。它也屬於G蛋白偶聯
受體家族,於是將其命名為Gaq-ER。
信號轉導途徑
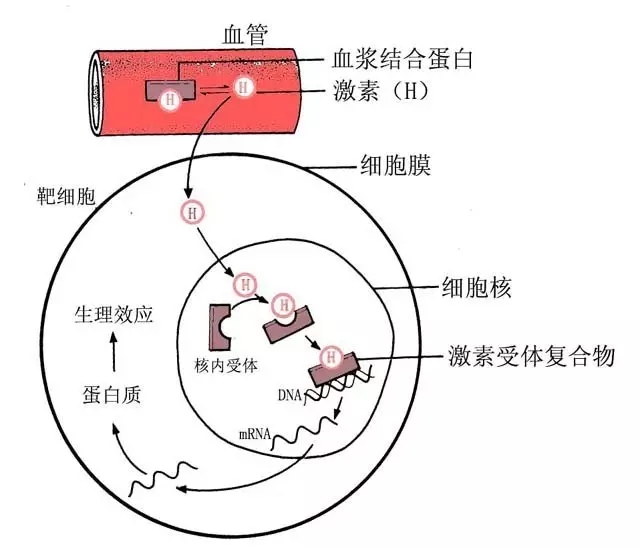
雌激素細胞內信號轉導包括:核啟動的類固醇信號傳送(nuclear-initiatedsteroidsignaling,NISS)即基因組作用模式和膜啟動的類固醇信號傳送(membraneinitiatedsteroid signaling,MISS)即為非基因組作用模式。
NISS
雌激素介導的基因組作用模式分為三步:雌激素通過擴散進入細胞或通過細胞內
原位合成,和核內ER結合,激活形成ER同源或異源二聚體,激活的ER與DNA
增強子雌激素
應答元件(estrogen responseelement,ERE)合,ER- ERE複合物促使形成轉錄
起始複合物並誘導轉錄。除ERE機制外,ER 還能結合到其他
轉錄因子,然後結合到靶基因啟動區的活化蛋白1(activating protein 1,AP-1)位點,調節基因轉錄活性。經典轉錄調控途徑:與配體結合的ER發生構型改變,形成同二聚體或異二聚體,二聚體與共調分子相互作用,與靶基因的ERE結合,啟
基因轉錄和翻譯。非經典轉錄調控途徑:ER通過結合AP-1、特異蛋白1(SP-1)等
增強子元件間接調控基因轉錄。在此信號途徑中,與配體結合的受體二聚體需要轉錄因子Fos Jun的共同作用而進行
轉錄激活。中間途徑:即無典型的ERE,如孕激素受體(PR)
啟動子只有半個ERE,位於AP-1和SP-1位點附近。這些區域在乳腺癌細胞雌激素調節的PR表達中都起作用,可能是ER增強AP-1和SP-1在半ERE的募集,或共激分子需要這兩種轉錄因子才能穩定地募集到啟動子。
MISS
雌激素能在數秒鐘內改變神經元的電生理特性,在幾分鐘之內降低不表達核受體的神經元的Ca2+電流,導致特異性增強基因表達的蛋白質如MAPK途徑、PKA、CREB等的活化。雌激素可以通過膜ER快速激活細胞內的
第二信號系統,間接調節一系列
基因轉錄,在多種細胞類型中快速發揮生物學效應。這些效應包括:(1)迅速激活ERK/MAPK
信號通路;(2)通過Gds活化腺苷酸環化酶(cAMP),促進cAMP調節基因轉錄的活性;(3)通過Gaq活化
磷脂酶C(PLC),激活PKC並增加內源性Ca2+;(4)通過Gai合成一氧化氮(NO);(5)增強Src-Ras-PI3K通路活性、
胞吐作用、泌乳素的分泌及鈣通路活性;(6)使Src、Src同源性膠原蛋白、
內皮黏附分子、環前列腺素和一些未知磷脂酶的表達水平增加。
ER介導的信號轉導途徑
MAPK/ERK信號轉導途徑——ER活化MAPK/ERK的過程主要靠相關分子形成複合體來介導,主要有ERα-Shc-IGFR複合體和PELPl/MNAR-ER-Src複合體。前者主要是在Shc 的PTB/SH2 結構和ERa 的AF-1的參與下,通過
磷酸化的Shc、IGFR與ERα結合,從而發揮生物效應。而後者中,PELP1/MNAR既定位於細胞核又定位於細胞膜,MNAR 和PELP1上有兩種不同的
模體,可以分別ERa、c-Src結合形成復體,從而發揮作用。PI3K/Akt
信號轉導途徑——PI3K與多種細胞因子轉導途徑相關,已有報導PI3K可以與EGFR和IGFIR相互作用,即可能有ERct-PI3K-生長因子受體複合體的存在,IGF-1R是乳腺癌
細胞增殖的關鍵受體,主要通過PI3K/Akt途徑
抑制細胞的凋亡。PI3K 可以介導多種細胞效應,而Akt則是PI3K的下游分子,Akt的
活化能是因為ERα與PI3K相互作用。雌激素可以通過Ras/PI3K/Akt通路誘導凋亡相關蛋白BAD的磷酸化,提PK3K/Akt
信號通路在雌激素抵抗腫瘤壞死因子、超氧化物等因素誘導凋亡的過程中具有潛在的重要意義。JNK
信號轉導途徑—— 在表達ER的CHO細胞中,E2通過ERβ激活JNK,而通過ERα抑制這種
激酶。JNK可以誘導細胞的凋亡作用,但有些激活JNK亡信號被存活信號通路所阻斷,包括NF-kB、Akt/
PKB和ERK。GPER1介導的信號轉導途徑MAPK/ERK信號轉導途徑—— 雌激素結合GPER1通過下游分子Src、Ras、Raf、Mek級聯快速激活ERK,促進細胞增生並延長其生長周期。MAPK激活後在胞質中激活一系列其他
蛋白激酶或進入核內引起
轉錄因子AP-l、NF-kB磷酸化而調控
基因的表達。用MCF-7乳腺癌細胞實驗首次證實雌激素可以通過激活ERK信號
級聯反應刺激乳腺細胞的增生。GPER1介導的MAPK途徑和下文介紹的PI3K途徑都是通過
反式激活EGFR來完成的。PI3K/Akt途徑——ER介導的PI3K-Akt-NO轉導途徑中,ER主要靠和其他配體結合成聚合體來起作用,如在血管內皮細胞中,膜ERα與Gai的
偶聯才促進雌激素刺激eNOS的活化。在單層扁平上皮細胞、成纖維細胞、
平滑肌細胞以及脂肪細胞中大量存在的小窩結構中,也是形成了一個ERα/紋蛋白/小窩蛋白/eNOS複合體來發揮作用的。GPER1介導的轉導途徑主要靠PI3K-Akt-NO途徑來完成,雌激素與GPER1結合後,激活
磷脂醯肌醇-3(PI3)
激酶,進而激活
蛋白激酶B(Akt)激酶,調節eNOS活性,產生NO。Vivacqua等發現活化的EGFR同時還能動員胞內鈣離子和激活磷脂醯肌醇-3激酶-Akt(PI3K/Akt)途徑,同樣達到促
細胞增殖的效果cAMP/PKA途徑—— 雌激素可以通過GPER1活化
腺苷酸環化酶(AC),並通過其作用使胞內環磷酸腺苷(cAMP)增加,激活cAMP依賴的
蛋白激酶A(PKA),使Raf-1失活而減少ERK的量, 進而調控
細胞生長。如雌激素可刺激cAMP-PKA途徑活化,激活cAMP
反應元件介導的轉錄活性,而使
細胞周期蛋白D1(Cyclin D1)的表達增高加速器分裂增殖。Ca2+途徑——Revankar等用離體研究發現在調節Ca2+途徑來實現生物效應;Dennis等發現在轉染了GPER1的SKBr3細胞也存在這種現象。Romanò等在體研究發現GPER1參與了雌激素對下丘腦促性腺激素釋放激素細胞內Ca2+的調節並涉及到GABAA受體。
ER-X和Gaq-ER介導的信號轉導途徑
ER-X介導的雌激素受到腦發育以及缺血性腦損傷的調節並涉及到MAPK-ERK1/2信號途徑,ERK1和ERK2 的激活對神經元的存活和生長非常重要。Qiu等在敲除ER鼠下丘腦的弓狀核用一種作用與雌激素相仿的非甾體類混合物STX來
靶向標記PLC-PKC-PKA,由此發現Gaq-ER參與了對PLC-PKC-PKA途徑的調節,具體程可能是:雌激素通過結合受體來激活Gaq,激活的Gaq再激活PLC,從而使PIP2水解出DAG激活PKC,PKC活化cAMP,升高的cAMP再激活PKA,從而使胞膜的鉀離子通道打開誘發相應的生物學效應。
分布及表達
雌激素受體的組織分布和表達量隨性別及年齡的不同有所區別在不同的組織中各種受體的含量及生物功能也有不同。
雌激素受體與骨組織
骨組織中,
核受體ERβ的含量比ERα含量高,它們的含量隨著年齡的增長而減少,ERα作用可調節成骨細胞的生長,而ERβ參與了骨的形成與
重吸收。GPER1也存在於骨細胞的成骨細胞和破骨細胞,在青春期時,它的表達處於低水平,但它的表達卻不隨著年齡的增長而發生特定的改變,它在骨組織中扮演的具體角色尚不清。
雌激素受體與生殖系統
子宮中雌激素受體以ERβ為主,可刺激子宮生長。GPER1在子宮內膜癌腫的表達高於正常子宮內膜。ERα主要在卵囊泡膜細胞和某些基質細胞中表達,ERβ存在於生長卵泡的顆粒細胞中,也可在一些基質細胞中表達。有研究發現GPER1在卵巢中的表達始於
原始卵泡,但它在卵巢癌中卻很低。在乳腺的上皮細胞(乳腺導管及小葉)和基質細胞中均發現了ERβ、ERα的表達而在小葉上皮中無表達。ERα對乳腺發育和泌乳至關重要,ERβ則關係不大,其表達隨年齡增加而增強。人類乳腺癌細胞膜上存在GPER1,可以促進MAPK和Akt激酶
信號通路的快速活化,GPER1 影響乳腺腫瘤的大小和轉移性,而且GPER1與腫瘤大小呈現正向的關係。
雌激素受體與神經系統
ER在大腦各區域的分布不同,與學習記憶有關的腦區如大腦皮層、海馬和基底前腦等部位以ERβ為主,而與生殖有關的腦區以ERα為主,兩者只共存於少數細胞。Gaq-ER和ER-X主要發現於神經系統中,在最近的研究中發現,在缺血性腦卒中、轉基因小鼠和阿爾茨海默病小鼠中,雌激素可通過MARK/ERK和PI3K/Akt
細胞信號傳導通路來快速、持續激活
膜受體,起到保護神經元的作用。它主要影響空間記憶和
突觸可塑性。
結語
綜上所述,雌激素對機體有著多方面的重要的調節作用,如參與神經退行性疾病、雌激素反應性腫瘤和骨質疏鬆等的發生。目前對於兩種經典雌激素受體的研究正在不斷的更新,而新的膜性受體也在不斷發現之中。但對它們在各組織、器官中的表達與生理功能仍缺乏全面的了解。雌激素受體種類素研究領域的複雜性,尚需要更進一步的深入研究。