研究歷史
50年代出現的蛋白激酶術語指催化酪蛋白,
卵黃高磷蛋白或其他蛋
白質磷酸化的酶。70年代在哺乳動物的十多種組織器官中又發現了一類很重要的蛋白激酶——
環腺苷酸(cAMP)蛋白激酶,以後在昆蟲和大腸桿菌中也有報導。
 蛋白激酶
蛋白激酶種類
到目前為止,已發現的蛋白激酶約有400多種,分子內都存在一個同源的由約270
胺基酸殘基構成的催化結構區。在
細胞信號傳導、
細胞周期調控等系統中,蛋白激酶形成了縱橫交錯的網路。這類酶催化從ATP轉移出磷酸並共價結合到特定蛋白質分子中某些
絲氨酸、
蘇氨酸或
酪氨酸殘基的
羥基上,從而改變蛋白質、酶的
構象和
活性。
蛋白激酶很多,根據其底物蛋白被磷酸化的
胺基酸殘基種類,可將它們分為5類,即:
①絲氨酸/蘇氨酸(Ser/Thr)蛋白激酶:蛋白質的羥基被磷酸化;
②酪氨酸(Tyr)蛋白激酶:蛋白質的酚羥基作為磷受體;
③組氨酸蛋白激酶:蛋白質的組氨酸、精氨酸或賴氨酸的鹼性基團被磷酸化,主要出現於“雙組分信號系統”(two-component signal system);
④
色氨酸蛋白激酶:以蛋白質的色氨酸殘基作為磷受體;
⑤天冬氨醯基/谷氨醯基蛋白激酶:以蛋白質的醯基為磷受體。
目前發現的植物蛋白激酶以前3類為主。而Stone和Walker(1995)根據蛋白激酶催化區域
胺基酸序列的相似性,將植物蛋白激酶分為5大組。這5大組蛋白激酶分別為①AGC組:以cAMP(
環腺苷酸)依賴的蛋白激酶PKA、cGMP(
環鳥苷酸)依賴的
蛋白酶PKG及鈣和磷脂依賴的蛋白激酶PKC為代表,以受
第二信使(如cAMP、cGMP、DAG(
二醯甘油)和Ca2+)激活為特徵。②CaMK組:包括Ca2+/CaM依賴的蛋白激酶CaMK、Ca+依賴而CaM不依賴的蛋白激酶CDPK等,依賴第二信使是該組蛋白激酶的普遍性。③CMGC組:包括MAPK(分裂原激活的蛋白激酶)、CDK(周期素依賴的蛋白激酶)等,相對於前2組蛋白激酶依賴於第二信使,該組激酶作用於下游的
磷酸化級聯繫統。④傳統的PTK組:為
酪氨酸蛋白激酶,目前在植物中尚未發現純粹的酪氨酸蛋白激酶,但並不意味著Tyr殘基的磷酸化對植物不重要。二重特異性蛋白激酶如MAPKK在植物中的發現,證明了Tyr殘基的磷酸化可能在高等植物中具有重要的生理作用。⑤其它組:如類
受體蛋白激酶RLKs及乙烯信號轉導元件CTRl(胞質級聯蛋白激酶MAPKKK)等。
蛋白激酶A(Protein kinase A,簡稱PKA),也稱為
環磷酸腺苷依賴蛋白激酶(cAMP-dependent protein kinase、簡稱cAPK)。是一種酶,其活性依賴於細胞中
環磷酸腺苷(cAMP)的含量。
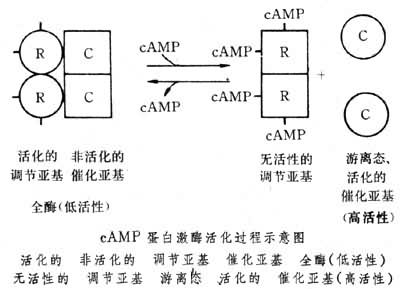
PKA是一個全酶(holoenzyme,由許多次單位組成,是完整的且有作用的酶),它包含了兩個調控次單位以及兩個代謝次單位。當細胞中的cAMP較少時,PKA雖然會暫時失去活性,但仍然可以保持結構完整。當cAMP濃度增加,cAMP會接上位於兩個調控次單位上的活性區(Binding site),並使蛋白激酶A的構形改變,進而將兩個代謝次單位釋放。自由的代謝次單位,則可以參與一些化學反應。
分布
cAMP蛋白激酶以活化型和非活化型兩種形式存在於生物體中,它們的比例受到多種激素的調節控制。cAMP蛋白激酶是由4個
亞基組成——兩個能與cAMP結合的
調節亞基(R)和兩個非活化的能催化磷酸基團轉移的
催化亞基(C)。如果細胞內cAMP濃度升高則cAMP蛋白激酶解離成調節雙亞基和兩個活化的催化亞基(見圖)。
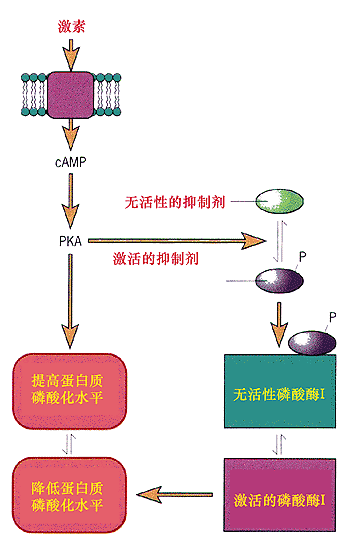
蛋白激酶在供體ATP和活化劑鈣離子(Ca2+)存在下,能把低
活性的
磷酸化酶激酶磷酸化,使它變為高活性的磷酸化酶激酶,後者又能把低活性的磷酸化酶b經磷酸化轉變成為高活性的磷酸化酶a,從而使糖原降解順利進行。在這同時,蛋白激酶又能使高活性的
糖原合成酶a
磷酸化成為低活性的糖原合成酶b,使糖原合成速度減慢。這樣在cAMP濃度的調節下使糖原的生成和降解代謝達到平衡。
 蛋白激酶
蛋白激酶80年代發現了
酪氨酸蛋白激酶,它可以催化自身
磷酸化,也可以磷酸化其他的蛋白質。其磷酸化反應專一地發生在特定的
酪氨酸的
羥基上。某些腫瘤病毒的變態蛋白以及一些生長因子的受體具有酪氨酸蛋白激酶活性。”
 蛋白激酶
蛋白激酶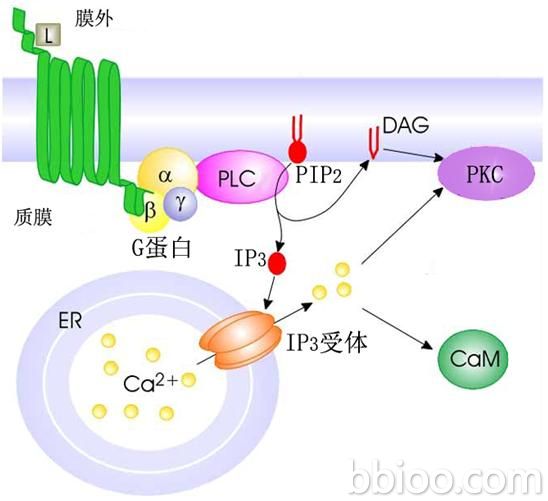
 蛋白激酶
蛋白激酶