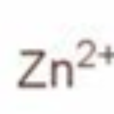鋅是一種藍白色金屬。密度為7.14克/立方厘米,熔點為419.5℃。在室溫下,性較脆;100~150℃時,變軟;超過200℃後,又變脆。鋅離子是鋅原子失去兩個電子。
基本介紹
- 中文名:鋅離子
- 英文名:Zinc ion
- 化學式:Zn2+
- 熔點:419.58℃
- 沸點:923℃
- 密度:7.14克/立方厘米
- 熔點:419.5℃
- 元素符號:Zn
- 元素類型:金屬元素
鋅簡介,鋅離子,發現簡史,元素描述,元素來源,環境影響,健康危害,毒理學資料,元素用途,
鋅簡介
一種藍白色金屬。密度為7.14克/立方厘米,熔點為419.5℃。在室溫下,性較脆;100~150℃時,變軟;超過200℃後,又變脆。聲音在其中的傳播速率:3850
莫氏硬度:2.5 鋅的化學性質活潑,在常溫下的空氣中,表面生成一層薄而緻密的鹼式碳酸鋅膜,可阻止進一步氧化。當溫度達到225℃後,鋅氧化激烈。燃燒時,發出藍綠色火焰。鋅易溶於酸,也易從溶液中置換金、銀、銅等。
鋅離子
由於鋅在常溫下表面易生成一層保護膜,所以鋅最大的用途是用於鍍鋅工業。鋅能和許多有色金屬形成合金,其中鋅與鋁、銅等組成的合金,廣泛用於壓鑄件。鋅與銅、錫、鉛組成的黃銅,用於機械製造業。含少量鉛鎘等元素的鋅板可製成鋅錳乾電池負極、印花鋅板、有粉腐蝕照像制板和膠印印刷板等。鋅與酸或強鹼都能發生反應,放出氫氣。鋅肥(硫酸鋅、氯化鋅)有促進植物細胞呼吸、碳水化合物的代謝等作用。鋅粉、鋅鋇白、鋅鉻黃可作顏料。氧化鋅還可用於醫藥、橡膠、油漆等工業。
元素名稱:鋅
元素符號:Zn
元素英文名稱:Zinc
相對原子質量65.39:
元素類型:金屬元素
原子序數:30
質子數:30
中子數:35
摩爾質量:65
所屬周期:4
所屬族數:IIB
核外電子排布:2-8-18-2
顏色和狀態: 帶藍的淺灰色
密度: 7.133 g/cm3(20 ℃)
熔點:419.6 ℃
沸點: 907 ℃
原子半徑(計算值):135(142)pm
發現簡史
鋅也是人類自遠古時就知道其化合物的元素之一。鋅礦石和銅熔化製得合金——黃銅,早為古代人們所利用。但金屬狀鋅的獲得比銅、鐵、錫、鉛要晚得多,一般認為這是由於碳和鋅礦共熱時,溫度很快高達1000 C以上,而金屬鋅的沸點是906C,故鋅即成為蒸氣狀態,隨煙散失,不易為古代人們所察覺,只有當人們掌握了冷凝氣體的方法後,單質鋅才有可能被取得。
世界上最早發現並使用鋅的是中國,在10~11世紀中國是首先大規模生產鋅的國家。明朝末年宋應星所著的《天工開物》一書中有世界上最早的關於煉鋅技術的記載。生產過程非常簡單,將爐甘石(即菱鋅礦石)裝滿在陶罐內密封,堆成錐形,罐與罐之間的空隙用木碳填充,將罐打破,就可以得到提取出來的金屬鋅錠。另外,我國化學史和分析化學研究的開拓者王鏈(1888─1966)在1956年分析了唐、宋、明、清等古錢後,發現宋朝的紹聖錢中含鋅量高,提出中國用鋅開始於明朝嘉慶年間的正確的科學結論。鋅的實際套用可能比《天工開物》成書年代還早。
鋅的名稱來源於拉丁文Zincum,意思是“白色薄層”或“白色沉積物”,它的化學符號Zn也來源於此,其英文名稱是Zinc。
世界上最早發現並使用鋅的是中國,在10~11世紀中國是首先大規模生產鋅的國家。明朝末年宋應星所著的《天工開物》一書中有世界上最早的關於煉鋅技術的記載。生產過程非常簡單,將爐甘石(即菱鋅礦石)裝滿在陶罐內密封,堆成錐形,罐與罐之間的空隙用木碳填充,將罐打破,就可以得到提取出來的金屬鋅錠。另外,我國化學史和分析化學研究的開拓者王鏈(1888─1966)在1956年分析了唐、宋、明、清等古錢後,發現宋朝的紹聖錢中含鋅量高,提出中國用鋅開始於明朝嘉慶年間的正確的科學結論。鋅的實際套用可能比《天工開物》成書年代還早。
鋅的名稱來源於拉丁文Zincum,意思是“白色薄層”或“白色沉積物”,它的化學符號Zn也來源於此,其英文名稱是Zinc。
元素描述
純鋅呈藍白色,有光澤。硬度2.5(莫氏硬度)。具有延展性。密度7.14克/厘米3。熔點419.58℃,沸點907℃。化合價+2。已知鋅有十五個同位素。是很好的導熱體和導電體。電離能9.394電子伏特。化學性質比較活潑,但在空氣中較穩定,與酸和鹼作用會放出氫氣。
元素來源
環境影響
健康危害
侵入途徑:吸入、食入。
鋅入量過多可致中毒,如食入鋅過多可引起急性鋅中毒,有嘔吐、腹瀉等胃腸道症狀;工廠鋅霧吸入可有低熱及感冒樣症狀;慢性鋅中毒可有貧血等症狀;動物實驗可致肝、腎功能及免疫力受損。有些兒童玩具的塗料含鋅,小兒喜把玩具放口內,常食入鋅過多可致中毒。
鋅入量過多可致中毒,如食入鋅過多可引起急性鋅中毒,有嘔吐、腹瀉等胃腸道症狀;工廠鋅霧吸入可有低熱及感冒樣症狀;慢性鋅中毒可有貧血等症狀;動物實驗可致肝、腎功能及免疫力受損。有些兒童玩具的塗料含鋅,小兒喜把玩具放口內,常食入鋅過多可致中毒。
毒理學資料
遷移轉化:天然水中的鋅以可溶的絡合物狀態存在。天然水中的鋅還要向底質沉積物遷移轉化。鋅可與天然水中的粘土礦物締合,被吸附在日格中成為吸著離子,吸持的形式為Zn2+、ZnOH+及ZnCl+。此時鋅隨同粘土礦物沉積遷移到底質中。鋅還可形成化學沉澱物向底質遷移。含鋅廢水排放到天然水體中後,在鹼性環境生成Zn(OH)2絮狀沉積物遷移到底質中。Zn2+與S2-有很的親合力,也可形成溶度積極小的ZnS沉積到底質中。測定結果表明,底質沉積物中含鋅範圍為45~2221ppm,平均110ppm,是水體中鋅含量的10,000倍。水生動植物有很強的吸收鋅的能力,致使水中的鋅向生物體內遷移。
一般說來,水生動植物體內鋅的濃度可比水相中鋅的濃度高出1000~100,000倍。因此鳳眼蓮、菹草、金魚草、浮萍有希望作污水中鋅的淨化植物。土壤中鋅的遷移性取決於土壤的pH值。鋅在酸性土壤中容易發生遷移。當土壤為酸性時,被粘土礦物吸附的鋅易於解脫,土壤中不溶的氫氧化鋅可和酸作用,轉變成可溶的Zn2+狀態,土壤中鋅以Zn2+為主,容易淋失遷移或被植物吸收,因此,缺鋅現象常常在酸性土壤中存在。
鋅濃度為2mg/L時,水有異味,濃度為5mg/L時水呈乳濁狀。
對生物降解的影響:水中濃度1-3mg/L時,廢水的生物處理受抑制。
對生物降解的影響:水中濃度1-3mg/L時,廢水的生物處理受抑制。
危險特性:具有強還原性。與水、酸類或鹼金屬氫氧化物接觸能放出易燃的氫氣。與氧化劑、硫黃反應會引起燃燒或爆炸。粉末與空氣能形成爆炸性混合物,易被明火點燃引起爆炸,潮濕粉塵在空氣中易自行發熱燃燒。
燃燒(分解)產物:氧化鋅。
燃燒(分解)產物:氧化鋅。
元素用途
元素輔助資料:
鋅和銅的合金——黃銅,
鋅離子