基本介紹
鈍性破壞
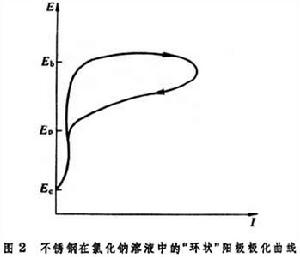 金屬鈍化
金屬鈍化
 金屬鈍化
金屬鈍化鈍化是使金屬表面轉化為不易被氧化的狀態,而延緩金屬的腐蝕速度的方法。另外,一種活性金屬或合金,其中化學活性大大降低,而成為貴金屬狀態的現象,也叫鈍化。...
化學清洗中最後一個工藝步驟,是關鍵一步,其目的是為了材料的防腐蝕。如鍋爐經酸洗、水沖洗、漂洗後,金屬表面很清潔,非常活化,很容易遭受腐蝕,所以必須立即進行鈍化...
金屬表面狀態變化所引起的金屬電化學行為使它具有貴金屬的某些特徵(低的腐蝕速率、正的電極電勢)的過程。若這種變化因金屬與介質自然作用產生,稱為化學鈍化或自鈍化...
鈍化定義為在氧化條件下通過強陽極極化使得金屬材料表面形成一層非常薄的保護層達到了阻礙腐蝕的一種狀態,這就是鈍化。金屬表面的薄膜就是鈍化膜。一些金屬或合金在...
金屬鈍化劑是汽油、噴氣燃料等的添加劑。常與抗氧防膠劑共用。用來抑制金屬,特別是銅對油品氧化的催化作用,以便充分發揮抗氧防膠劑的作用,減少抗氧防膠劑用量。...
金屬鈍化是一種界面現象,因為金屬本身的性能不變,只是使金屬表面在介質中的穩定性發生了變化。金屬由活性狀態轉變為鈍態是個較複雜的過程,對其機理尚有不同解釋,...
由陽極極化引起的金屬鈍化現象,叫陽極鈍化或電化學鈍化。陽極鈍化是作為陽極的金屬或化合物在電流作用下,不同程度地失去轉入溶液的能力。一般認為陽極鈍化是陽極表面...
鈍化作用是指金屬或合金在特殊條件下陽極過程受阻礙而失去化學活性,產生耐蝕狀態的一種現象。...
金屬防鏽鈍化液採用日本高新研發技術,不鏽鋼酸洗、鈍化合二為一,在鈍化的同時能清除工件表面的油污、銹斑、焊斑、氧化層、游離鐵等污垢,處理後表面變成均勻銀白色...
不鏽鋼鈍化zj-301:金屬經氧化性介質處理後,其腐蝕速度比原來未處理前有顯著下降的現象稱金屬的鈍化。...
鐵、鋁在稀HNO3或稀H2SO4中能很快溶解,但在濃HNO3或濃H2SO4中溶解現象幾乎完全停止了,碳鋼通常很容易生鏽,若在鋼中加入適量的Ni、Cr,就成為不鏽鋼了。金屬或...
鋅是一種活潑的金屬,鋅電鍍後如果不進行很好的後處理,鍍層很快就會變暗,並相繼出現白色腐蝕產物。為了減少鋅的化學活性,往往採用鉻酸鹽溶液來鈍化處理,使鋅層表面...
金屬在酸性溶液中的陽極鈍化,是由於外加電流使金屬由活化態進入鈍化態。但是在腐蝕過程中,人們十分重視在沒有任何外加極化的情況下,金屬表面上產生的自鈍化現象及其...
鈍化是將金屬置於亞硝酸鹽、硝酸鹽、鉻酸鹽或重鉻酸鹽溶液中處理,使金屬表面生成一層鉻酸鹽鈍化膜的過程。常作為鋅、鎘鍍層的後處理,提高鍍層的耐蝕性;有色金屬...
電解鈍化(electrolysis passivation)是指電化學鈍化。一種陽極金屬的電化學溶解陡然大幅度減緩乃至幾乎不溶的現象。和化學鈍化一樣,電化學鈍化也是由於金屬表面形成了一...
又稱自動鈍化(autopassivation)。金屬與鈍化劑的自然作用而產生的鈍化現象。如鉻、鋁、鈦等金屬在空氣和很多種含氧的溶液中,都易於被氧所鈍化,故這些金屬稱為自...
用途:對不鏽鋼全面酸洗鈍化,清除各類油污、銹、氧化皮、焊斑等污垢,處理後表面變成均勻銀白色,大大提高不鏽鋼抗腐蝕性能,適用於各種型號不鏽鋼零件、板材及其設備。...
鈍化機,拖曳式拋光機(工件可通過在缸體內的磨料進行打磨或拋光)最初被套用在珠寶行業中,對戒指進行拋光。...
鈍化型緩蝕劑passivating inhihitor能使活化性金屬從活化狀態進人鈍化狀態的緩蝕劑。又稱鈍化劑。...
三價鉻鈍化是用於工業生產加工的一項技術。...... 第二代三價鉻鈍化劑的共同特點是採用有機絡合劑,並加入其他金屬,耐蝕性大大提高,並可以得到不同鈍化膜的顏色...
環保不銹鐵鈍化液SL-367採用日本高新研發技術,專門針對馬氏體不鏽鋼最新研發的環保型鈍化液;用來替代防鏽油、脂等防鏽方法。...
金屬表面狀態發生變化,使它具有貴金屬的低腐蝕速率和正電極電勢增高等特徵的過程。...... 金屬與周圍介質自發地進行化學作用而產生的金屬鈍化稱為化學鈍化或自鈍化作...
