鈍化現象
由於陽極反應受到阻礙而使金屬耐腐蝕性能提高, 這種現象稱為鈍化。有化學鈍化和電化學鈍化。化學鈍化是指金屬表面因化學作用生成某些極薄的 “保護膜”使金屬本身與外界介質隔絕, 不再受到腐蝕。例如,鋁在空氣中氧化生成一層極薄的氧化膜,鐵經濃硝酸或其他一些強氧化劑處理都可鈍化。金屬鈍化後,電極電勢向正的方向移動。用電化學方法也可以使金屬鈍化, 把金屬作為陽極, 加上適當電壓, 陽極電勢就向正的方向移動, 如同時記錄其電流變化, 即可得到陽極極化曲線(如下圖)。在曲線AB段上金屬出現正常的陽極溶解;當電勢達到B點時,由於在金屬表面上開始形成鈍化膜(一般是氧化膜或氧的吸附層, 金屬溶解速度隨電位變正很快減小。如BC段, 稱為陽極鈍化。B點對應的電位稱為鈍化電位, 對應的電流稱為鈍化電流; 在CD段上電極處於穩定的鈍態,金屬停止溶解;在DE段上電流再度隨電位變正而增大,電極上又發生了氧化過程,通常稱為超鈍化現象。其原因可能是金屬以高價態溶解或發生了其他的陽極反應,例如,氧的析出, 用電化學鈍化使金屬得到保護的方法叫陽極保護。
鈍化膜理論
金屬鈍化是一種界面現象,因為它沒有改變金屬本身的性能,只是使金屬表面在介質中的穩定性發生變化。金屬由活性狀態轉變為鈍態是一個比較複雜的過程,因此人們對鈍化的認識也是逐步深化的。直到現在為此還沒有很完整的理論來說明所有的鈍化現象。下面扼要介紹目前認為能較滿意地解釋大部分實驗事實的兩種理論,即成相膜理論和吸附理論。
成相膜理論
又稱薄膜理論。關於鈍化了的金屬表面有一層薄的保護膜的假說很早就提出來了。但是,由於受到當時科學條件的限制,引起人們長時間的爭論。後來有人首先通過實驗發現鈍化金屬表面的光學性質(如折射率)改變了,以後又藉助化學和電化學腐蝕方法將這層肉眼看不見的薄膜從金屬表面上分離了下來。選用適當的溶劑可單獨溶去基底金屬而留下鈍化膜,列如使用I2-KI甲醇溶液便可分離出鈍化膜。至此,成相膜理論才逐漸為大家所接受。近年來,運用X光衍射儀、橢圓偏振儀、電子顯微鏡、光電子能譜儀等表面測試儀器對鈍化膜的成分、結構、厚度進行了廣泛的研究。
成相膜理論認為,當鈍化金屬陽極溶解時,可以在其表面生成一層緻密的、覆蓋性良好的固體產物薄膜。這層保護膜構成獨立的固相,從而將金屬表面與介質機械地隔開,阻礙陽極過程進行,使金屬的溶解速度大大降低。鈍化膜通常是氧和金屬的化合物,例如鐵的鈍化膜是γ-Fe2O3、γ-FeOOH,鋁的鈍化膜是無孔的γ-Al2O3,覆蓋在它上面的是多孔的β-Al2O3。除此之外,有些鈍化膜是金屬難溶鹽組成的,如鉛在硫酸中生成硫酸鉛膜,鐵在氫氟酸中生成氟化鐵膜。鉻酸鹽、矽酸鹽以及磷酸鹽都能對金屬起到有效保護作用。現在已能用光學方法和電化學方法測出不少金屬鈍化膜的厚度。鈍化膜的厚度一般在25~30Å,碳鋼約為90~100Å,不鏽鋼為9~10Å。不鏽鋼的鈍化膜最薄,但最緻密,保護作用最好。金屬鋁在空氣中氧化生成的鈍化膜厚度為20~30Å,也具有良好的保護作用。
成相膜從其電化學性質來說可以分成兩類:電子導體與非電子導體。電子導體膜雖能阻止金屬的陽極溶解過程,但其他依靠電子來實現兩相間的電荷遷移過程的電極反應仍可以進行。非電子導體膜不僅使金屬的陽極溶解過程難以進行,而且其他的電極反應也難進行。但是當這層膜非常薄時(厚度小於Å),電子可藉助隧道效應通過膜,從而具有電子導體的性質。所以,不管那一種情況,金屬達到鈍態後電極反應並未完全停止,僅僅是溶解速度大幅度降低。
鈍態金屬上氧化膜的厚度隨著電極電位正移而增厚,從橢圓偏振技術研究中十分清楚地看到了這種結果。在臨近活化電位EF時飩化膜是最薄的。在這種情況下,如果在金屬/氧化物界面上存在著機械應力,則很容易引起鈍化膜破裂,形成缺陷。當在金屬表面形成了初始鈍化膜後,膜的繼續生長和金屬的溶解過程都是透過完整的膜實現的。由於膜的兩側電位相差十分之幾至幾V,膜又極薄,故膜內電場非常高,可達到106~107V/cm。在這樣強的電場作用下金屬離子通過膜遷移到膜/溶液界面上,與陰離子O發生作用,或者是陰離子通過膜向金屬/膜界面遷移。
綜上所述,成相膜理論認為為了實現穩定的鈍態,鈍化膜還應滿足以下條件。
(1) 鈍化膜必須將整個金屬表面遮蓋起來。
(2) 鈍化膜各處是均勻的,而且與金屬本體結合很牢固。
吸附理論
吸附理論卻認為薄膜的機械覆蓋保護作用在金屬鈍化中並不起主要作用。金屬建立鈍態時常常不需要在其表面上有可以分離的形成單獨相的固體產物膜,而只要在表面上生成氧或含氧粒子的吸附就夠了。甚至只要部分表面有氧吸附層也可達到鈍態,如Pt在HCl中只要有6%的表面充氧,就能使鉑的溶解速度降至1/4,若有12%的鉑表面充氧,則其溶解速度會降低16倍之多。因此,金屬鈍化是由於表面生成氧或含氧粒子的吸附層,改變了金屬/溶液界面的結構,並使陽極活化能顯著提高的緣故。也就是說,金屬鈍化是由於金屬表面本身的反應能力降低,而不是膜的機械隔離作用。該理論首先由德國人塔曼(Tamman)提出,後為尤利格(Uhlig)教授等加以發展。
吸附理論的主要實驗依據是測量界面電容的結果。測量界面電容是揭示界面上是否存在成相膜的有效方法。若界面上生成了哪怕是很薄的膜,其界面電容也要比自由表面上雙電層電容的數值小得多。但測量結果表明,在Cr18Ni9Ti不鏽鋼表面上,金屬發生鈍化後界面電容變化不大,它表示鈍化金屬表面並不存在成相氧化膜。另外,測量實現鈍化所需電量的結果也表明,所需電量遠不足以生成氧的單分子吸附層,即在金屬表面上根本不需要形成一個單分子層的氧就可引起極強的鈍化作用。這種理論認為,只要在最活潑的,最先溶解的表面區域上(例如金屬晶格的頂角或邊緣或者在晶格的缺陷、畸變處)吸附著氧單分子層,便能抑制溶解過程,使金屬鈍化。
在金屬表面吸附的含氧粒子究竟是哪一種,這要由腐蝕體系中的介質條件來決定,可能是OH離子,也可能是OH離子,更多的人認為可能是氧原子。有人假設吸附過程是這樣進行的:當金屬與電解質溶液接觸時,其表面原子幾乎完全被吸附水分子覆蓋,並在表面電荷作用下水的偶極子作定向排布(見圖1)。若金屬表面荷正電,則水偶極子中氧端朝向金屬。當金屬電位足夠高時,被吸附水分子將質子傳遞給鄰近分子,形成一個氧離子O化學吸附單層。然後,金屬晶格上的正離子進入O離子間的位置,產生牢固吸附在金屬表面上的單分子氧化膜,又稱吸附氧。
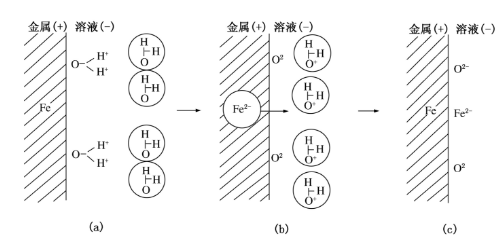 圖1 氧吸附過程示意圖
圖1 氧吸附過程示意圖提高陽極電位,氧的化學吸附膜將被加厚。如果加厚過程中這層膜能保持原來的緻密性,則它對陽極過程的阻力也將提高。這種較厚的化學吸附膜乃是由純化學吸附膜向成相膜過渡的中間層,故又稱阻擋層。阻擋層實質上是多層吸附膜,具有無定形結構,且氧的含量是變化的。因此我們可將它看作是無定形非化學計量氧化物。它的性質明顯地不同於最終生成的化學計量氧化物。進一步提高陽極電位,阻擋層將繼續增厚,直至生成成相膜。由於在吸附膜變厚過程中內應力增大,或者與外界活性物質發生化學反應,使鈍化膜發生開裂和局部出現空隙,從而破壞了原來的緻密性。所以,成相氧化膜對金屬鈍化的貢獻一般沒有最初生成的緊貼金屬表面的氧化學吸附膜和阻擋層大。金屬鋁在陽極氧化過程中可生成厚度達100~200μm的成相膜,遠遠超過了氧單分子層的厚度。金屬鈦、鉬、鎢、鎂等在氧化介質中或通過陽極氧化也可生成較厚的成相膜。
總之,取決於金屬或腐蝕介質條件,發生鈍化的原因可以是氧在金屬表面上一些活性點的吸附或者生成緻密的單分子或多分子氧化學吸附膜,甚至是生成厚的氧化物固體產物膜。顯然,這些不同的鈍化膜對陽極溶解過程的阻礙作用是不一樣的,有的僅僅起機械隔離作用,有的卻改變金屬表面的雙電層結構和電極表面的反應能力。成相膜理論和吸附理論都能較好地解釋相當一部分實驗事實,它們的區別似乎不在於膜是否對金屬的陽極溶解具有阻滯作用,而在於為了引起鈍化現象到底在金屬表面上應發生怎么樣的變化。至今還不清楚在什麼條件下可生成成相膜,它們又是如何在各種活性陰離子作用下受到破壞的。所以弄清這些問題不僅有助於解決實際問題,而且將有助於更深入地揭示鈍化現象的本質,相信在積累更多的實驗數據的基礎上,一定會提出突破性的新理論。
Fe和Cr的鈍化
人們對鈍化層的研究已經超過160年。隨著高新探測科技的發展彌補了對鈍化膜難以測試的技術上的許多不足,人們對鈍化膜有了逐步全面的了解,這裡只介紹Fe和Cr鈍化的一些重要特點。
1. 結構組成
Fe的鈍化層較薄,其結構一般由Fe3O4內層與γ-Fe2O3外層組成。內層Fe3O4有高密度缺陷,易於導電。Fe的鈍化層屬電子過剩型n型半導體。Fe基合金的鈍化層中富集合金元素,尤其是Cr。而Cr會優先Fe生成比較穩定的鈍化膜。其他純金屬或合金具有不同的特性,其鈍化膜的成分隨極化電位不同而改變。
鈍化氧化膜理論的基礎是Evans建立的。Uhlig強調了化學吸附氧對鈍化的重要性。吸附氧層不是阻礙陽極溶解,而是降低了交換電流密度。過渡金屬的d層未成對電子有利於氧的化學吸附。Fe-Cr合金中的Cr可以從Fe接納d層的未成對電子。當Cr含量小於12%的時候,Cr的d層未成對電子空位被過多的Fe的d電子填滿,此時的FeCr合金其實相當於一個不含Cr的Fe,在脫氧酸中不能鈍化。當Cr在FeCr合金中含量超過12%時,Cr的d層未成對電子對化學吸附氧產生作用,FeCr合金在脫氧酸中產生鈍化。此外, H、H3O和OH都對鈍化起著直接的作用。在鈍化形成與成長的初期,Lorenz認為,Fe經歷下列複雜的反應:
Fe +H2O → (FeOH)ads+H+e(1)
(FeOH)ads→ (FeO)ads+H+e(2)
(FeO)ads+H2O → (FeOO)ads+H+e(3)
吸附是鈍化形成與生長的起始階段,最終生長發展為穩定的氧化物。
2. 生長動力學
一般認為,在初次鈍化電位Epp以下的活化區,鈍化膜的形成過程是一個與金屬溶解過程互相競爭的動態過程,一旦電位高於Epp進入穩定的鈍化電位區,鈍化膜就開始生長增厚,這個結論可以從鈍化電流隨時間下降的實驗現象證明。鈍化腐蝕電流與時間成反比關係,即ipass=k/t, k是比例常數。而鈍化電流密度ipass又必須正比於鈍化膜形成的速度,即鈍化膜增厚的速度dx/dt,即ipass=k' dx/dt。所以積分可得鈍化膜生長遵從對數方程:
x=A +B lg t
其中,x是鈍化膜厚度,A和B是常數。這個方程可以用連續吸附的過程理論推導出來。
3. 電子傳輸反應
雖然離子的遷移受到鈍化層的阻礙會降低陽極腐蝕電流ipass,但其電子的導電性依然很高。電子如此容易地傳遞能夠使半電池電極反應在能維持穩定鈍化的高電位下控制表面電位。這種導電行為說明鈍化膜具有半導體性質。而半電池反應動力學可以用來確定鈍化膜中的電子傳輸,從大多數鈍化電極在陰極極化下電子傳輸易於在陽極極化時傳輸的特點表明,這些鈍化電極為n型半導體。
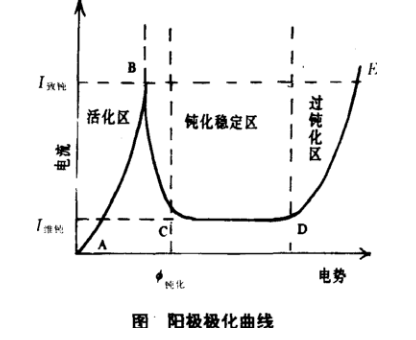
 圖1 氧吸附過程示意圖
圖1 氧吸附過程示意圖
