基本介紹
- 中文名:滴定誤差
- 外文名: titration error
- 別名:終點誤差
- 套用學科:分析化學
定義
來源
影響因素
試樣的稱量
指示劑
 滴定誤差
滴定誤差誤差公式












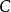













研究意義




 滴定誤差
滴定誤差











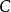















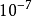

滴定誤差(titration error)又稱終點誤差(end point error)。滴定分析中,利用指示劑的變色來確定滴定終點,滴定終點與等當點不一致時所產生的誤差,稱為終點誤差,它...
滴定終點誤差是分析化學中由於指示劑的變色不恰好在化學計量點,而使滴定終點與化學計量點不相符合產生的相對誤差。...
滴定分析法,是化學分析法的一種,將一種已知其準確濃度的試劑溶液(稱為標準溶液)滴加到被測物質的溶液中,直到化學反應完全時為止,然後根據所用試劑溶液的濃度和...
滴定是指一種定量分析的手段,也是一種化學實驗操作。它通過兩種溶液的定量反應來確定某種溶質的含量。它是根據指示劑的顏色變化指示滴定終點,然後目測標準溶液消耗體積...
終點誤差(end point),也稱為滴定誤差。是指利用指示劑的變色來確定滴定終點與化學計量點不一致所而產生的誤差。...
滴定分析是將已知準確濃度的標準溶液滴加到被測物質的溶液中直至所加溶液物質的量按化學計量關係恰好反應完全,然後根據所加標準溶液的濃度和所消耗的體積,計算出被...
誤差是測量測得的量值減去參考量值。測得的量值簡稱測得值,,代表測量結果的量值。所謂參考量值,一般由量的真值或約定量值來表示。 對於測量而言,人們往往把一...
一般實驗室滴定分析採用的是人工滴定法,它是根據指示劑的顏色變化指示滴定終點,然後目測標準溶液消耗體積,計算分析結果。自動電位滴定法是通過電位的變化,由儀器自動...
滴定分析中,當滴定至等當點時,往往沒有任何外觀效果可供判斷,常藉助於指示劑的顏色變化來確定終止滴定,此時指示劑的變色點,即為滴定終點。...
是以絡合反應(形成配合物)反應為基礎的滴定分析方法,又稱配位滴定。絡合反應廣泛地套用於分析化學的各種分離與測定中,如許多顯色劑,萃取劑,沉澱劑,掩蔽劑等都...
分析化學中,在化學計量點前後±0.1%(滴定分析允許誤差)範圍內,溶液參數將發生急劇變化,這種參數(如酸鹼滴定中的pH)的突然改變就是滴定突躍。...
操作誤差,由於操作人員的生理缺陷、主觀偏見、不良習慣或不規範操作而產生的誤差。是與操作人員的素質有關的,因此,又稱為個人誤差。...
系統誤差又叫做規律誤差。它是在一定的測量條件下,對同一個被測尺寸進行多次重複測量時,誤差值的大小和符號(正值或負值)保持不變;或者在條件變化時,按一定規律...
酸鹼中和滴定,是用已知物質量濃度的酸(或鹼)來測定未知物質的量濃度的鹼(或酸)的方法叫做酸鹼中和滴定。實驗中甲基橙、甲基紅、酚酞等做酸鹼指示劑來判斷是否完全...
間接滴定法是滴定分析的一種,某些待測組分不能直接與滴定劑反應,但可通過其它的化學反應,間接測定其含量。對於不能直接與滴定劑反應的某些物質,可預先通過其他反應...
酸鹼滴定法是指利用酸和鹼在水中以質子轉移反應為基礎的滴定分析方法。可用於測定酸、鹼和兩性物質,是一種利用酸鹼反應進行容量分析的方法。用酸作滴定劑可以測定鹼...
絡合滴定法是以絡合反應為基礎的滴定分析方法稱。它主要以氨羧絡合劑為滴定劑,這些氨羧絡合劑對許多金屬有很強的絡合能力。...
是以沉澱反應為基礎的一種滴定分析方法。...... 這樣,在等當點之後又消耗較多的NH4SCN滴定液,造成較大的滴定誤差。2.滴定條件及注意事項(1)為了避免上述轉化反應...
