過渡態理論即活化絡合物理論,(transition-state theory)。過渡態:以量子力學對反應過程中的能量變化的研究為依據,認為從反應物到生成物之間形成了勢能較高的活化絡合物,活化絡合物所處的狀態叫過渡態。
基本介紹
- 中文名:過渡態理論
- 外文名:transition-state theor
- 又名:活絡化合物理論
- 時間:1935年
- 提出:A.G.埃文斯和M.波拉尼
- 又名:絕對反應速率理論
簡介
發現簡史
定律定義
理論觀點
過渡態
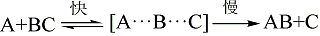
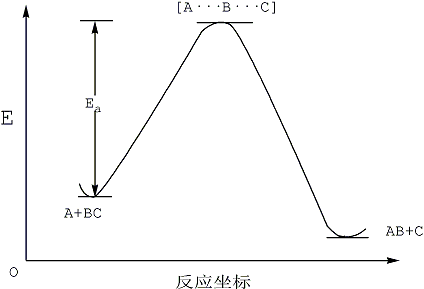

過渡態理論即活化絡合物理論,(transition-state theory)。過渡態:以量子力學對反應過程中的能量變化的研究為依據,認為從反應物到生成物之間形成了勢能較高的活化絡合物,活化絡合物所處的狀態叫過渡態。
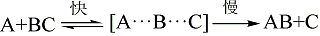

過渡態理論即活化絡合物理論,(transition-state theory)。過渡態:以量子力學對反應過程中的能量變化的研究為依據,認為從反應物到生成物之間形成了勢能較高的活化...
過渡狀態理論認為正逆反應在進行過程中,都必須經過同一活化體這樣一個過渡狀態。過渡狀態理論吸取了碰撞理論的合理部分,把活化能的概念提高到化學鍵的角度來理解。...
過渡態理論方法又稱活化配合物理論方法或絕對反應速度理論方法,是研究基元反應的機理和反應速度的一種理論方法。1935年由埃林(Eyring)、波蘭尼(Polanri)等人在統計...
過渡態是指反應物體系轉變成產物體系過程中,經過的能量最高狀態(或稱活化絡合物)。過渡態鍵的狀況是:舊鍵未完全斷裂,新鍵未完全形成。過渡態是不穩定的,不能...
過渡預算理論出自2015年長春大學優秀畢業論文《大數據時代電子商務企業的預算管理研究》(劉義進,黃曉紅副教授指導),是基於預算管理中各環節海量數據的處理在整個預算...
哈蒙德假說(Hammond's Postulate)有時也被稱為賴費勒假設(Leffler's assumption),是有機化學中根據過渡態理論而產生的假說,和有機化學反應的過渡態有關。哈蒙德...
5 的。過去對 β 二級同位素效應的原因有過很多爭論, 隨著過渡態理論的發展, 人們更多地用到超共軛效應去解釋 β 二級同位素效應 。支持超共軛作用解釋 β 二級...
因此,現行的反應速率理論(如雙分子反應碰撞理論、過渡態理論)仍不得不借用經典統計力學的處理方法。這樣的處理必須作出某種形式的平衡假設,因而使這些速率理論不適用...
這箇中間態相當於過渡態,後來用過渡態理論也導出了類似的關係式。原鹽效應對於帶同種電荷的離子間的反應,反應速率隨離子強度增大而增大;對於帶異種電荷的離子間的...
過渡態理論的優點1. 形象地描繪了基元反應進展的過程,說明了反應途經的含義;2. 原則上可以從原子結構的光譜數據和勢能面計算反應的速率常數k,故又稱絕對反應速率...
三、表面反應速率的過渡態理論四、俘獲傳輸的表面反應五、提要第四節表面反應能量學參考文獻第三章研究方法第一節反應機理的動態研究方法...
Houghes—Ingold用過渡態理論來處理溶劑對反應速率的影響。經常遇到的反應,由起始反應物之間相互作用所生成的過渡態大都是偶極性活化配合物,它們在電荷分布上比相應...
2·5 與過渡態理論有關的幾個概念及推論2·6 活化參數與反應機理主要參考書參考文獻第3章 化學反應的動力學規律與反應機理3·1 動力學表示式的建立...
穿透係數pencnration c}e}}irient用量子)J學對傳統的過渡態理論進行的修正有三方面:( L)不用經典勢壘,改用影子能壘進行零點能修正;1L)反應坐標仍依經典處理,...
證明可以通過碰撞理論、過渡態理論、RRKM理論等模型實現。這裡通過碰撞理論作個簡單證明:對基元反應 A+B->產物-dN(A)/dt/V=-NAd[A]/dt/V=Zexp(-Ec/RT)...
學派,用海特勒-倫敦計算H2的方法建立了H+H2反應體系的第一個勢能面,藉助統計力學方法計算了在該勢能面上的熱平衡反應速率常數,稱為絕對反應速率理論或過渡態理論。...
of Jerusalem, Israel )和魏茲曼科學院 ( Weizmann Institute of Science, Israel ),進行分子的代數理論及動力學對稱性,量子Monte Carlo及新量子過渡態理論的研究。...
某些情況下亦可採用平衡態的近似,運用統計力學或過渡態理論等統計方法則,只需要在少量關鍵位置進行電子結構和振動計算就得到關於分子的分布或反應速率等信息。...
