鮑林近似能級圖
1939年鮑林(L.Pauling)從大量光譜實驗數據中,總結出了在多電子原子中原子軌道能量高低的順序,並得出了鮑林的近似能級圖。
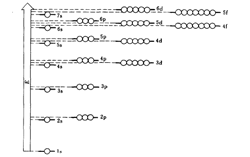 鮑林近似能級圖
鮑林近似能級圖鮑林近似能級圖中小圓圈代表
原子軌道,它是按原子軌道能量高低順序排列起來的。由下至上,代表原子軌道的能量逐步遞增。同一水平位置上的原子軌道為等價軌道。鮑林把能量接近的軌道分為一組,代表一個能級組,這樣總共分成7個能級組。這7個能級組的軌道能量是隨主量子數增加而增大的,當主量子數n相同時,原子軌道能量按角量子數遞增而遞增的次序排列,如E
ns<E
np<E
nd<E
nf。 而從第四能級組以後開始出現了能級交叉現象。
近似能級圖基本上能簡單明了地表達多電子原子中原子軌道的能量分布情況,但它與實驗的結果只能大致相符,也有少數元素會出現例外,由於鮑林近似能級圖並未考慮到原子軌道能量的高低還與原子序數有關,因而不能反映出不同原子的相同
原子軌道的能量高低。故鮑林能級圖僅僅是一種近似的能級圖。
科頓原子軌道能級圖
為了表明原子軌道能量與原子序數間的關係,在1962年科頓(F.A.Cotton)在光譜實驗的基礎上,提出了科頓原子軌道能級圖。科頓通過理論上的計算,得出了多電子原子中各個原子軌道的能量,並以原子軌道能量為縱坐標,原子序數為橫坐標,繪出了表示兩者關係的能級圖。
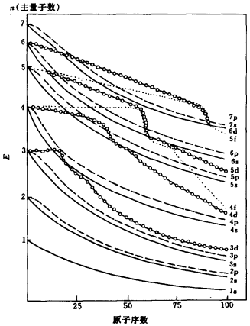 科頓原子軌道能級圖
科頓原子軌道能級圖由圖可以清晰看到以下兩點。
1、原子軌道的能量是隨著原子序數的增大而降低的加,電子數增加,核對電子的吸引力增強,因而原子中各原子軌道的離核距離減小,軌道能量會降低。然而不同原子軌道能量的下降幅度卻不盡相同,如s、p軌道隨原子序數增加,軌道能量是平緩地逐步降低的。但d、f軌道能量卻出現了跳躍式的降低,開始下降比較緩慢,甚至變化不大,而當原子序數增加至軌道上出現了d、f電子時,d、f軌道的能量急劇下降。
2、圖中顯示了有些元素的原子軌道有能級交叉現象。如4S軌道與3d軌道能量有交叉。多電子原子中電子的能量主要由n,l決定,而對於不同原子序數的原子,軌道能量受n、l的影響不盡相同,如原子序數為1~14的原子的軌道能量主要由主量子數(n)決定。n越大,軌道能量越高。
影響軌道能量的因素
在多電子原子中,電子不僅受核的吸引作用,同時還要受到電子間的排斥作用,以及電子之間交換能的影響。由於不同元素原子的 原子核電荷及電子數不同,所以電子受到的作用和影響也不同,從而使每一種元素原子軌道能量都有各自的數值。
1、禁止效應
在中心力場的Slater模型中,核外某一電子受其餘電子的排斥作用,可以平均起來看作是這些電子所產生的電子云的作用,並且把這種作用歸結為抵消了部分核電荷。我們把一電子對另一電子產生抵消核電荷的影響稱為禁止效應。
對於l值相同的同一類型軌道來說,隨著主量子數n的增大,其徑向分布的主峰離核越遠,使得核對電子的吸引減弱,同時受到其它電子的禁止越多,總的禁止常數σ也越大,所以軌道能量也就越高。
2、鑽穿效應
由於l不同,軌道電子云徑向分市不同,電子云鑽到核附近的j幾率不同,因而引起軌道能量不同的現象稱為鑽穿效應。
在多電子原子中,每個電子既被其它電子所禁止,同時又對別的電子起禁止作用,而這兩者的大小決定於考慮的電子在空間出現的幾率分布,在原子核附近,電子出現了幾率較大的軌道稱為鑽得較深的軌道,在這種軌道上運動的電子可以較好地避免其它電子的禁止,平均受到的有效核電荷較大,因而軌道能量較低,相反它卻可以給其它電子造成較大的禁止。鑽穿效應可使電子所受的禁止作用大大降低,起到了增加有效核電荷,降低軌道能量的作用。
 鮑林近似能級圖
鮑林近似能級圖 科頓原子軌道能級圖
科頓原子軌道能級圖