基本介紹
意義,遵守原則,排布方法,書寫方法,關係,
意義
遵守原則
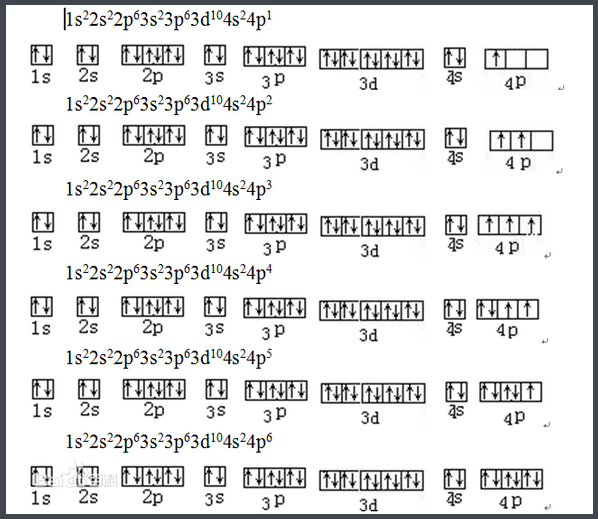
泡利不相容原理
可以簡單敘述為:一個原子軌道中最多只能容納兩個電子,並且這兩個電子的自旋方向必須相反。因而可知s亞層只有一個軌道,因而最多只能容納兩個電子,p亞層有三個軌道,最多可容納六個電子······也可以得知,第一電子層K層中因只有1s亞層,所以最多可容納兩個電子,而第二電子層L層中有2s和2p亞層,總共可以容納八個電子,可的第n層中最多可容納的電子數為2乘以n的平方個電子。
能量最低原理
自然界一個普遍的規律是“能量越低越穩定”。原子中的電子也是如此。在不違反泡利原理的條件下,電子優先占據能量較低的原子軌道,使整個原子體系能量處於最低,這樣的狀態是原子的基態。
洪特規則
從光譜實驗結果總結出來的洪特規則有兩方面的含義:一是對於基態原子,電子在能量相同的軌道排布時,將儘可能分占不同的軌道並且自旋方向相同;洪特規則的第二個含義是對於同一個電子亞層,當電子排布處於
全滿(s2、p6、d10、f14)
半滿(s1、p3、d5、f7)
全空(s0、p0、d0、f0)時比較穩定。
排布方法
書寫軌道表示式除須遵守上述三個原則之外,還要參考核外電子的排布方法。在此僅作簡單的介紹:
對於某元素原子的核外電子排布情況,先確定該原子的核外電子數(即原子序數、質子數、核電荷數),如24號元素鉻,其原子核外總共有24個電子,然後將這24個電子從能量最低的1s亞層依次往能量較高的亞層上排布,只有前面的亞層填滿後,才去填充後面的亞層,每一個亞層上最多能夠排布的電子數為:s亞層2個,p亞層6個,d亞層10個,f亞層14個。最外層電子到底怎樣排布,還要參考洪特規則,如24號元素鉻的24個核外電子依次排列為
1s22s22p63s23p64s23d4
根據洪特規則,d亞層處於半充滿時較為穩定,故其排布式應為:
1s22s22p63s23p64s13d5
最後,按照人們的習慣“每一個電子層不分隔開來”,改寫成
1s22s22p63s23p63d54s1
書寫方法
利用能量最低原理、泡利不相容原理和洪特規則,參考基態原子的核外電子在原子軌道上的排布順序,首先應確定原子核外電子的數目,再確定其排布順序,最後根據泡利不相容原理和洪特規則寫出其軌道表示式。
值得說明的是,因元素的化學性質與價電子的數目密切相關,因而多數情況下,為了便於研究化學性質與價電子的數目之間的關係,常常只寫出原子的價電子的軌道表示式,而內層電子的軌道的表示則可以簡化表示,即用相應的稀有氣體的元素符號加方括弧表示。