螯合作用是指金屬等中心元素能形成螯合物的過程。人體內所攝取的無機鐵之中,實際上被吸收的只有2-10%而已,將礦物質變成可被消化的形態時,通常都加上胺基酸,使它變成“螯狀”的化合物。由中心離子和某些合乎一定條件同一多齒配位體的兩個或兩個以上配位原子,鍵合而成具有環狀結構的配合物的過程稱為螯合作用。
基本介紹
- 中文名:螯合作用
- 外文名:Chelation
- 領域:化學
- 特點:具有環狀結構
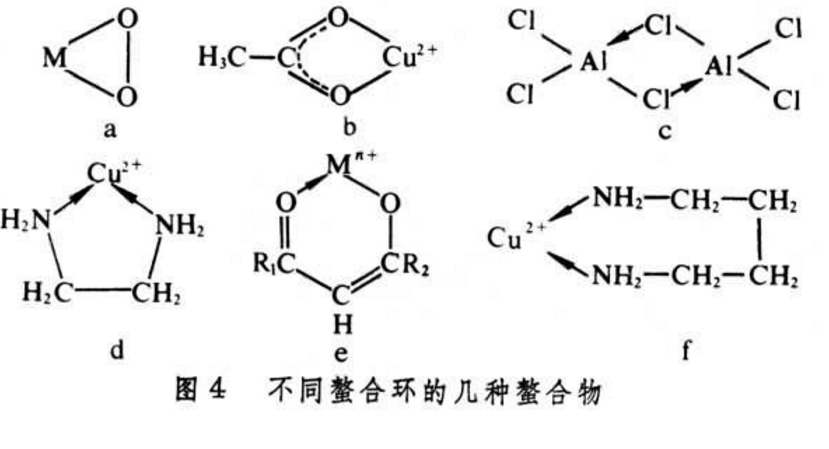
螯合作用是指金屬等中心元素能形成螯合物的過程。人體內所攝取的無機鐵之中,實際上被吸收的只有2-10%而已,將礦物質變成可被消化的形態時,通常都加上胺基酸,使它變成“螯狀”的化合物。由中心離子和某些合乎一定條件同一多齒配位體的兩個或兩個以上配位原子,鍵合而成具有環狀結構的配合物的過程稱為螯合作用。
螯合作用是指金屬等中心元素能形成螯合物的過程。人體內所攝取的無機鐵之中,實際上被吸收的只有2-10%而已,將礦物質變成可被消化的形態時,通常都加上胺基酸,使它...
金屬原子或離子與含有兩個或兩個以上配位原子的配位體作用,生成具有環狀結構的絡合物,該絡合物叫做螯合物。能生成螯合物的這種配體物質叫螯合劑,也稱為絡合劑。...
螯合物是具有環狀結構的配合物,是通過兩個或多個配位體與同一金屬離子形成螯合環的螯合作用而得到。...
對同一種原子,若形成螯合物比單基配位體形成的絡合物(非螯合物)要更加穩定,這種反應稱作螯合反應。螯合物一般以五元環、六元環為最穩定,且一個絡合劑與中心...
對同一種原子,若形成螯合物比單基配位體形成的絡合物(非螯合物)要更加穩定,這種效應稱作螯合效應。螯合物一般以五元環、六元環為最穩定,且一個絡合劑與中心...
螯合淋溶作用簡稱螯淋作用是指土壤中金屬(螯合淋溶作用)離子與有機質結合成配合物或螯合物向下層淋溶的作用。土壤中很多有機配位化合物,含有羧基、羥基或氨基等...
金屬螯合劑(metal chelating agent)可以通過螯合劑分子與金屬離子的強結合作用,將金屬離子包合到螯合劑內部,變成穩定的,分子量更大的化合物,從而阻止金屬離子起作用...
螯合物在化學上叫做絡合物,它是由一個大分子配位體與一個中心金屬原子連線所形成的環狀結構。能與金屬離子起螯合作用的有機分子化合物稱為螯合劑,或叫配體。螯合...
螯合治療編輯 鎖定 本詞條缺少信息欄、名片圖,補充相關內容使詞條更完整,還能...金屬離子失去活性,並以鰲合物的形式將有毒金屬從尿或糞中排出,起到解毒作用。...
螯合分散劑是一種高效多用途的有機螯合物,它可以軟化水質,對Ca2+、Mg2+、Fe3+等金屬離子有很強的螯合力及浮渣分散力,防止染整加工過程中沉澱物的生成及其它污物...
螯合態養分,是指由多齒配體形成螯合物狀態的養分。是具有環狀結構的配合物,由兩個或多個配位體與同一金屬離子通過螯合作用形成螯合環而得到。配體和金屬離子間...
螯合酵素催化劑樣的催化作用催動著機體的生化反應,催動著生命現象的進行。若沒有酵素,生化反應將無法進行,五大營養素都將變的對機體毫無用處,生命現象將會停止。它...
螯合型離子交換樹脂是指包含具有螯合能力的基團,通過螯合作用能對特定離子進行選擇性吸附並進行離子交換的樹脂。...
螯合劑軟化法 chelate softening for water經螯合劑的作用使硬水中的Ca2+,Mg2+生成穩定的螯合物而被去除,以降低水的硬度的方法。採用該方法處理,化學藥劑成本較高...
淋溶作用是指土壤物質中可溶性或懸浮性化合物(黏粒、有機質、易溶鹽、碳酸鹽和鐵鋁氧化物等)在滲漏水的作用下由土壤上部向下部遷移,或發生側向遷移的一種土壤...
