原因
生成的新物質與反應物的
能量不同,而反應體系又遵守
能量守恆,故任何一個化學變化一定表現出能量的吸收和放出,通常化學反應的能量變化又主要是以
熱能形式變化(除此之外還可能有
電能、
光能、
聲能等)。
反應的熱效應
定義
當
系統發生了化學變化之後,系統的溫度回到反應前始態的溫度,系統放出或吸收的熱量,稱為該反應的熱效應。研究化學反應中熱與其他
能量變化的
定量關係的
學科叫做熱化學。
測試方式
熱效應可以如下測定:使物質在熱量計中作
絕熱變化,從熱量計的溫度改變,可以計算出應從熱量計中取出或加多少熱才能恢復到始態的溫度,所得結果就是等溫變化中的熱效應。
任何物質總是和它周圍的其他物質相聯繫著的,為了
科學研究的需要,尤其在考慮諸如
熱化學這方面的內容時,必須規定待研究物質的範圍,也就是要把被研究的對象和周圍的物質隔離開來。這種被研究的對象叫做系統,系統以外的周圍物質叫做環境。
系統可以通過一個邊界(範圍)與它的環境區分開來;這個邊界可以是具體的,也可以是假想的。例如,在一隻容器里研究硫酸與
氫氧化鈉在
水溶液中的反應,通常就把含有硫酸和氫氧化鈉的水溶液作為系統,而溶液以外的周圍物質如容器、溶液上方的空氣等作為環境。顯然,這系統與環境是通過溶液的界面這個具體的邊界區分開來的,如果用鋅來代替氫氧化鈉,鋅將會與
稀硫酸反應產生
氫氣,逸出液面而擴散到空氣中。若該容器是完全密閉的,則可以將密閉在容器中的空氣以及產生的氫氣包括在系統內,該系統還是可以有具體的邊界與環境區分開。若該容器不是密閉的,則系統與環境的邊界只能是假想的。
熱反應方程式
意義
熱
化學方程式是表示化學反應中的物質變化和能量變化或熱量變化。例如熱化學方程式:
H2(g) + Cl 2(g) = 2HCl(g)△H = -183 kJ/mol
ΔH代表在標準態時,1molH2(g)和1molCl2(g)完全反應生成2 molHCl(g),反應放熱183kJ。這是一個假想的過程,實際反應中
反應物的投料量比所需量要多,只是過量反應物的狀態沒有發生變化,因此不會影響反應的反應熱。
標準態時化學反應的摩爾焓變稱為標準摩爾焓,用符號ΔfHmO表示。
書寫
(1)反應熱與溫度和壓強等測定條件有關,所以書寫時指明反應時的溫度和壓強(25℃、101kPa時,可以不註明)
(2)各物質化學式右側用圓括弧()表明物質的聚集狀態。可以用g、l、s分別代表
氣態、
液態、固態。固體有不同
晶態時,還需將晶態註明,例如S(斜方),S(
單斜),C(
石墨),C(金剛石)等。溶液中的反應物質,則須註明其濃度,以aq代表
水溶液,(aq,∝) 代表無限稀釋水溶液。
(3)熱化學方程式中化學計量數隻表示該物質的物質的量,不表示物質分子個數或原子個數,因此,它可以是整數,也可以是分數。
(4)
△H只能寫在化學方程式的右邊,若為
放熱反應,則△H為“-”;若為
吸熱反應,則△H為“+”。其單位一般為kJ/mol。同一化學反應,若
化學計量數不同時△H的值不同。若
化學計量數相同,當反應物、生成物狀態不同時,△H的值也不同。
(5)熱化學方程式是表示反應已完成的數量。由於△H與反應完成
物質的量有關,所以方程式中化學式前面的
化學計量數必須與△H相對應,當反應逆向進行時,其
反應熱與正反應的反應熱數值相等,符號相反。
(6)不標“↑”或“↓”
(7)不註明反應條件,例如:△(加熱)
(8)有機熱化學方程式用“=”,不用“→”
蓋斯定律
講到熱力學方程式,不得不提起蓋斯定律。
1840年
瑞士的化學家
蓋斯(Hess)在總結大量實驗事實(熱化學實驗數據)的基礎上提出:“
定壓或定容條件下的任意化學反應,在不做其它功時,不論是一步完成的還是幾步完成的,其熱效應總是相同的(反應熱的總值相等)。”這叫作
蓋斯定律。換句話說,化學反應的反應熱只與反應體系的始態和終態有關,而與反應的途徑無關,而這可以看出,
蓋斯定律實際上是“
內能和焓是狀態函式”這一結論的進一步體現。利用這一定律可以從已經精確測定的反應熱效應來計算難於測量或不能測量的反應的熱效應。
由於熱力學能(U)和焓(H)都是
狀態函式,所以ΔU和ΔH只與體系的始、末狀態有關而與“歷程”無關。可見,對於
恆容或恆壓化學反應來說,只要
反應物和產物的狀態確定了,反應的
熱效應Qv或Qp也就確定了,反應是否有中間步驟或有無
催化劑介入等均對Qv或Qp數值沒有影響。
放熱反應
化學反應所釋放的能量是現代能量的主要來源之一。化學反應一般以熱和功的形式與外界進行能量交換,而主要以熱的形式。
辨別方式
不同
物質內部能量是不同的,而整個反應過程中能量又是守恆的。
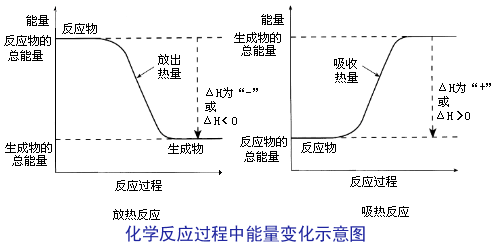
反應物和
生成物的能量差異常以
熱量的形式表現出放熱和吸熱,如果反應物和生成物兩者能量相近,則吸、放熱不明顯。 當反應物的總能量高於生成物的總能量,則放出熱量。
當反應物的總能量低於生成物的總能量,則吸收熱量。
按反應過程中熱量的變化,通常把化學反應分為
放熱反應、
吸熱反應。
放熱反應有熱量放出的化學反應。 原因:反應物具有的總能量高於生成物具有的總能量。
燃燒與
緩慢氧化,中和反應。 金屬與酸反應製取
氫氣,
生石灰和水反應等。
②吸熱反應:有熱量吸收的化學反應。
原因:反應物具有的總能量低於生成物具有的總
能量。
常見的吸熱反應: C(s)+H2O(g) CO(g)+H2O
C+CO2 2CO,Ba(OH)2·8H2O+NH4Cl的反應。
以及:KClO3、KMnO4、CaCO3的分解等。
注意問題
化學反應中的能量變化主要表現為
放熱和
吸熱,反應是放熱還是吸熱主要取決於
反應物、
生成物所具有的總能量相對大小。放熱反應和吸熱反應在一定條件下都能發生。反應開始時需加熱的反應可能是
吸熱反應,也可能是
放熱反應。反應的熱量變化與反應發生是否需要加熱沒有必然聯繫。
為什麼許多
反應(如煤的燃燒、H2的燃燒等)在反應時要加熱呢?這是因為,在常溫下能穩定存在的物質,其自身能量不是很高,加熱或光照可提高反應物的能量,使反應物分子運動速率增大,分子間相互碰撞發生反應的機會增大,使反應容易進行。當反應開始後,若反應放出的能量夠繼續維持或超過開始反應所需要能量,則停止加熱時反應繼續進行,這就是
放熱反應;若反應時放出的熱量不足以提供繼續反應所需要的能量,則要持續不斷的加熱反應才能進行,這就是
吸熱反應。