基本介紹
磺醯化簡介
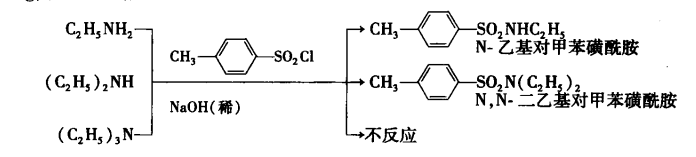 磺醯化反應
磺醯化反應在仲胺生成的磺醯胺分子中,氮原子上沒有氫原子,不能與氫氧化鈉反應生成鈉鹽,故不溶於氫氧化鈉水溶液;叔胺分子中的氮原子上沒有氫原子,不與磺醯氯反應。利用這些性質,可以鑑別和分離伯胺、仲胺、叔胺。
磺醯化作用
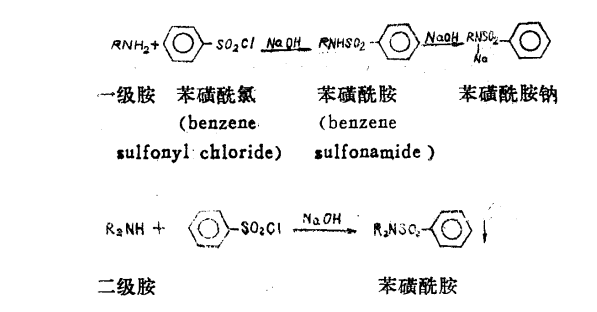 磺醯化作用
磺醯化作用磺醯化套用
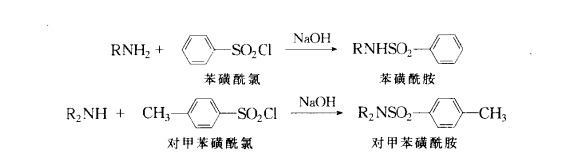 磺醯化反應
磺醯化反應 磺醯化反應
磺醯化反應 磺醯化作用
磺醯化作用 磺醯化反應
磺醯化反應烷基磺醯化或脫氫烷基磺醯化:ArH+SOCl2—→ArSOAr;ArH+ArˊSO2Cl—→ArSO2Arˊ用芳基磺醯氯和Friedel—Crafts催化劑處理芳香族化合物可以形成二芳基碸。這個...
氯次磺醯化。hlnra5ulfenation任有機化分翎分於甲fl 人氯次磺酞墓c-}c-.ry而生成次磺酞氯的反應。次磺酸氯是 由二硫化物經氯解生成的,例如: LCH3(cH2...
主要用於灼傷感染、化膿性創面感染、眼科疾病等,如磺胺醋醯(SA)、磺胺嘧啶銀鹽(SD-Ag)、甲磺滅膿(SML)。 抗菌作用 磺胺類藥對許多革蘭氏陽性菌和一些革蘭...
氯磺化聚乙烯(CSM)是美國Dupont公司於1952年首先實現工業化的。氯磺化聚乙烯由...傳統溶劑法:是採用氯氣、二氧化硫等作氯磺醯化劑的液相製造工藝,其主要缺點為...
特性 在分子中引人烷基磺酸基(1250五一》或芳基磺酞基[ ArSCI:一)的反應過程。如芳族化合物i在三氯化鋁存在下用芳基磺酞氯2處理,可得到芳基磺酞化產物3 ...
即氯化和亞磺醯化。是有機合成中產物中間體常常經過的兩個過程。氯化反應一般指將氯元素引入化合物中的反應。在有機化學反應中,氯化反應一般包括置換氯化、加成...
氯化苯磺醯是一種化學物質,分子式是C6H5ClO2S。...... 外文名 Benzenesulfonyl chloride 中文別名 氯化苯磺醯;BSC;苯磺醯氯化物 分子式 C6H5ClO2S 目錄...
收錄不同化學修飾下(磺醯化,磷酸化,脂醯化,醯胺化,乙醯化等)寡糖活性結構及功能的實驗數據。建立計算機輔助的寡糖活性結構及功能的推測系統。...
13.6.3胺的烷基化13.6.4胺的醯基化13.6.5胺的磺醯化13.6.6胺與亞硝酸的反應13.6.7胺的氧化13.6.8芳環上的取代反應...
四、胺的烴基化反應501五、胺的醯基化反應和磺醯化反應501六、季銨鹼和霍夫曼消除反應503七、胺的氧化和科普消除反應506八、胺與亞硝酸的反應508...
C12~C18烷烴經磺醯氯化反應,轉化率達到50%,然後再氯化,再與苯酚在氫氧化鈉存在下進行酯化然後用次氯酸鈉脫色、脫水、壓濾,得成品。...
14.3.2烷基化反應339 14.3.3醯基化反應339 14.3.4磺醯化反應340 14.3.5與亞硝酸反應341 14.3.6胺甲基化反應 (Mannich反應)343 14.3.7胺的氧化和Cope...
13 5 3醯基化31513 5 4磺醯化31613 5 5氧化31613 5 6與亞硝酸的反應31713 5 7與醛的反應31813 5 8芳胺環上的親電取代反應318...
13.6.4胺的醯基化13.6.5胺的磺醯化13.6.6胺與亞硝酸的反應*13.6.7胺的氧化13.6.8芳環上的取代反應*13.7季銨鹽和季銨鹼...
