拉烏爾定律
相關詞條
- 拉烏爾定律
拉烏爾定律是物理化學的基本定律之一,作為溶液熱力學研究的基礎,它對相平衡和溶液熱力學函式的研究起指導作用,是法國人拉烏爾在1880年所提出的。該定律廣泛套用於...
- 活度
對組分i的活度可按拉烏爾定律計算,得到 亨利定律圖示 aR,其活度係數用γi表示,濃度用Ni表示;也可按亨利定律計算,得到aH,其活度係數根據冶金工作者的慣例用fi...
- 依數性
由此與1887年發現拉烏爾定律,並於理論方面找出凝固點下降和沸點上升與蒸氣壓下降的關係,此時范特霍夫的溶液學說也已經成立,又找出它們三者和滲透壓的關係,於是在...
- 理想溶液
理想溶液 ideal solution(s)溶液中的任一組分在全部濃度範圍內都符合拉烏爾定律的溶液稱為理想溶液。理想溶液忽略不計分子、離子及其他微小質點相 互作用影響的一...
- 離子活度係數
而在真實溶液中,組分i-組分i間的作用力和組分i-其他組分間的作用力並不相等,導致了組分i並不滿足拉烏爾定律,其化學勢也不滿足以上關係,即偏離了理想溶液的...
- 實際溶液
實際溶液是實際存在的溶液,實際溶液的溶劑不遵守拉烏爾定律,溶質也不遵守亨利定律。...
- 稀溶液
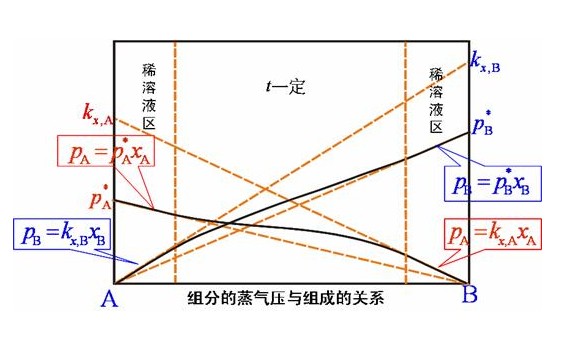
稀溶液中的溶質遵從亨利定律,其溶劑遵 從拉烏爾定律,所以稀溶液也可如下定義:“在定溫定壓下,溶劑服從拉烏爾定律而溶質服從亨利定律的溶液,就叫作稀溶液”。 [...
- 標準態
對後一種熔體,通常以拉烏爾定律為基礎,採用純物質作為標準態,以摩爾分數表示其濃度。以摩爾百分數(多用於有色金屬) 或質量百分數(多用於鋼鐵) 表示其濃度。亨利...
- 理想液態混合物
如果兩種純液體組分能按任意的比例相互混溶,那么就會形成理想液態混合物。在一定的溫度和壓力下,液態混合物中任意一種物質在任意濃度下均遵守拉烏爾定律...
- 互溶體系
兩個純液體可按任意比例互溶,每個組分都服從拉烏爾定律,這樣組成了理想的完全互溶雙液系,或稱為理想的液體混合物。通常,兩種結構相似或極性相似的化合物可以按...
- 甑
也可根據乙醇的多化規律,人為地填加酒精成分,採取甑桶蒸餾輔助器,根據拉烏爾定律,最大濃度地提取香味成分,利用甑桶,可生產出高質量的串蒸酒。一般情況下,清香型...
- 吉布斯相律
在“相律”提出前後的一個時期內,曾有一些學者甚至是一些著名學者對相平衡間題獨立地作過研究,也得出一些規律,如早期的拉烏爾定律、亨利定律以及“相律”提出後但...
- 凍結點
拉烏爾定律 影響因素 食品的種類、死後條件等 定義 冰晶開始出現 目錄 1 定義 2 食品凍結點 3 幾種食品的凍結點 凍結點定義 編輯 食物的凍結點就是指食...
- 臥式甑
也可根據乙醇的多化規律,人為地填加酒精成分,採取甑桶蒸餾輔助器,根據拉烏爾定律,最大濃度地提取香味成分,利用甑桶,可生產出高質量的串蒸酒。一般情況下,清香型...
- 煙塵率
其次是爐渣中的在高溫下的直接揮發,在錫冶煉過程中為得到高品質的粗Sn,不得不把爐渣中的含Sn量控制在一定的水平,這部分錫在冶煉過程高溫下,遵循拉烏爾定律揮發...
- 蒸餾
由拉烏爾定律,在一定壓力下,稀溶液中溶劑的蒸氣壓等於純溶劑的蒸氣壓乘以該溶劑在溶液中的摩爾分數:p溶劑=po溶劑x溶劑式中p溶劑、po溶劑分別是溶液中溶劑的蒸氣...
- 路易斯蘭德爾規則
式中p為純液體組分i的飽和蒸氣壓,此式即為拉烏爾定律。V百科往期回顧 詞條統計 瀏覽次數:次 編輯次數:3次歷史版本 最近更新: 創建者:洛克菲le...
- Goff-Gratch方程式
拉烏爾定律 亨利定律 參考資料 1. Wexler, A. (1976). "Vapor pressure formulation for water in range 0 to 100°C. A revision" (PDF). J. Res. ...
- VLE
對於大多數氣體的稀溶液,氣液間的平衡關係可用拉烏爾定律和亨利定律表示。 VLE虛擬學習環境 編輯 VLE是Virtual learning environment的縮寫,意思是虛擬學習環境。 ...
- 范特霍夫因子
依數性 拉烏爾定律 范托夫方程 滲透壓 參考資料 1. Daniel L. Reger; Scott R. Goode; David W. Ball. Chemistry: Principles and Practice 3. ...
- 共結點
由於共結系中各組元彼此起著雜質的作用,根據拉烏爾定律互相使凝固點降低。共結點即為各組元凝固點下降曲線的交點。因此,共結點溫度顯著低於各單相和其他混合物的...
- 威廉·奧斯特瓦爾德
他們用這套設備驗證了拉烏爾定律,並對范托夫當時提出的滲透壓等概念進行了測量。1900年左右奧斯特瓦爾德在對溶液粘度性質的測量時,發明了奧斯特瓦爾德黏度計,至今仍然...
- 揮發度
當混合物中液相為理想溶液且汽相為理想氣體時,套用拉烏爾定律和道爾頓分壓定律,可由式(2)導出:(4)式中p1和p2分別為組分A和B的飽和蒸氣壓。此時相對揮發度為...
- 完全互溶雙液體系
兩個純液體可按任意比例互溶,每個組分都服從拉烏爾定律,這樣組成了理想的完全互溶雙液系,或稱為理想的液體混合物。通常雙液系可分為三類:(1)無恆沸點雙液系...
 原子摩爾分數
原子摩爾分數