環加成反應,cycloaddition reaction
兩個共軛體系結合成環狀分子的一種雙分子反應。通過環加成反應,兩個共軛體系分子的端基碳原子彼此頭尾相接,形成兩個σ鍵,使這兩個分子結合成一個較大的環狀分子,例如丁二烯與乙烯(或它們的衍生物)的加成反應。
基本介紹
- 中文名:環加成反應
- 外文名:cycloaddition reaction
- 例如:丁二烯與乙烯加成反應
- 套用:分子軌道對稱守恆原理
- 屬性:反應
- 學科:化學
反應過程
反應實例
環加成反應,cycloaddition reaction
兩個共軛體系結合成環狀分子的一種雙分子反應。通過環加成反應,兩個共軛體系分子的端基碳原子彼此頭尾相接,形成兩個σ鍵,使這兩個分子結合成一個較大的環狀分子,例如丁二烯與乙烯(或它們的衍生物)的加成反應。



環加成反應,cycloaddition reaction兩個共軛體系結合成環狀分子的一種雙分子反應。通過環加成反應,兩個共軛體系分子的端基碳原子彼此頭尾相接,形成兩個σ鍵,使這兩...
(1,3-dipolar cycloaddition)是發生在1,3-偶極體和烯烴、炔烴或相應衍生物之間的環加成反應,產物是一個五元雜環化合物。烯烴類化合物在反應中稱親偶極體。德國...
通過環加成反應如第爾斯 - 阿爾德(Diels-Alder)反應或1,3-偶極環化加成反應,生成含有環狀結構聚合物的聚合。 套用學科 材料科學技術(一級學科),高分子材料(...
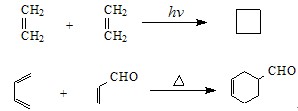
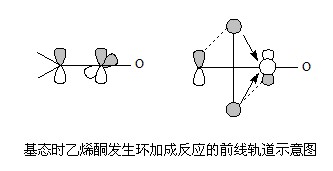
光化環加成}holr}chemical cycloaddiiion在光的作用下,一個分子的激發態和另一分子的基態發生的環加成反應。...
在加熱條件下,共軛二烯烴與含碳碳雙鍵或碳碳三鍵的化合物進行1,4-環加成反應,生成六元環烯烴,反應也經過一個環狀過渡態。成環反應需要的溫度比開環反應的溫度...
特性 由烯丙基負離子參與的2十3環加成反應。例如a-甲墓苯乙烯1在強鹼二異丙氨基鏗作用下成為烯內基負離子2,與1.2一二苯乙烯混合,發生2+3環加成,即1,3一...
de Mayo反應,從1,3-二酮產生的烯酮和烯烴進行[2 + 2]-光化學環加成後,進行反-羥醛縮合得到1,5-二酮的反應。...
普拉托反應(英語:Prato reaction)是發生在富勒烯或碳納米管與亞甲胺쭩內鹽之間的1,3-偶極環加成反應。...
Bingel反應(Bingel reaction)是 C60 與溴代丙二酸酯在鹼(如氫化鈉、DBU)存在下加成為單一的 6-6 閉環產物的反應。產率較高。...
螯鍵反應是一類周環反應。 周環反應是涉及具有原子的環狀陣列的過渡態和相關的相互作用軌道的循環陣列的反應。 σ和π鍵的重組發生在這個循環陣列中。在一個原子...
不對稱環化反應(Asymmetric cyclization reaction),也可以稱作不對稱成環反應、手性環化反應,是一類利用分子空間結構或者手性催化劑,使原本還有對稱結構的底物形成新的...
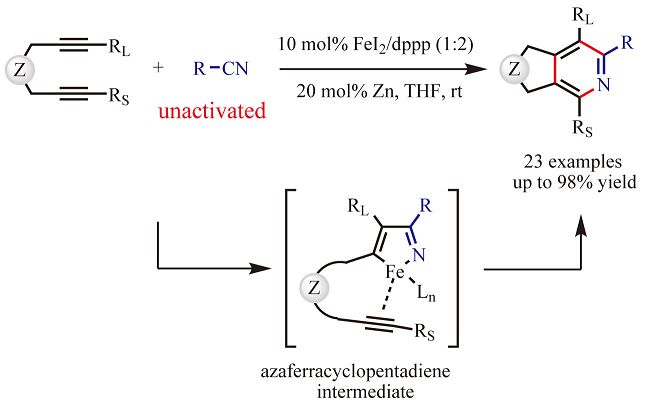
2015年,北京大學余志祥教授發展了使用銠催化的乙烯基環丙烷環加成反應作為關鍵步驟來構建cis-四氫苯並呋喃骨架。其合成路線以鄰甲氧基苯酚為起始原料,先後通過光延...
Horner反應(維蒂希-霍納爾反應)、Horner-Wittig反應,這是一個是用氧化膦穩定的碳負離子與醛加成,生成β-羥基氧化膦,而後與鹼作用,消除生成烯烴的反應,是Wittig反應...
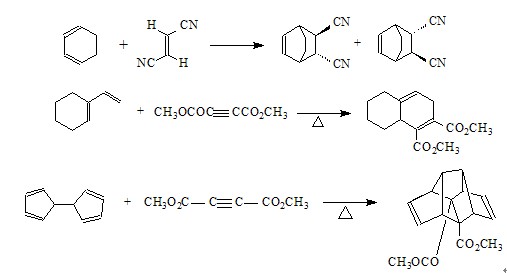
狄爾斯-阿爾德反應(Diels-Alder reaction)是一種有機反應(具體而言是一種環加成反應)。共軛雙烯與取代烯烴(一般稱為親雙烯體)反應生成取代環己烯。即使新形成的...
α-羰烷基化反應、β-羥烷基化反應、β-羰烷基化反應、亞甲基化反應、α,β-環氧烷基化反應以及環加成反應等,並從反應機理、影響因素、適用範圍等進行了詳細介紹...
波瓦羅夫反應是發生在芳基亞胺(由苯胺類與苯甲醛類縮合產生)與富電子烯烴或烯烴衍生物之間的表觀環加成反應。...
[3+2]偶極子環加成反應的一種。該反應優點是有極高的產率而且具有很好的官能團選擇性。即使底物中含有其他官能基團,但是能夠僅僅只是炔基與疊氮之間的發生反應。該...
雙烯加成,又名狄爾斯-阿爾德反應(Diels-Alder反應,或譯作狄爾斯-阿德爾,第爾斯-阿德爾等等),由共軛雙烯與烯烴或炔烴反應生成六元環的反應,是有機化學合成反應...
反之,像丁二烯的對旋環化和[2+2]環加成反應,則稱為對稱禁阻的反應。這裡的“允許”與“禁阻“,只表示一個基元步驟或協同過程的難易程度。一個對稱禁阻的反應...
親電加成反應(EA),簡稱親電加成,是親電試劑(帶正電的基團)進攻不飽和鍵引起的加成反應。反應中,不飽和鍵(雙鍵或三鍵)打開,並與另一個底物形成兩個新的σ鍵...
加熱時炔丙基鹵化物或硫酸酯與疊氮化鈉在二惡烷-水混合物中發生兩個連續的重排反應,生成1,2,3-三唑環。...
在環狀有機化合物頂端一個成環碳原子再經環化,生成螺環化合物的反應。螺環化合物為抗菌劑的發展開闢了新的領域,螺環化合物的兩環平面相互垂直,對於雜環螺環...
環丙酮。是環丙烷的氧代衍生物。其熔點為-90°C,很不穩定, 可由乙烯酮與重氮甲烷在二氯甲烷中於-78℃反應製得,在-78℃以下可存在於乙醇、二氯甲烷等有機溶劑...
吡咯環是一種很有效的化學物質,它的化學特性很強。吡咯環合成是通過3,3’-二...1. 含氮Ylide對C60的1,3—偶極環加成反應法合成含吡咯環C60 詞條...
用二炔的[2+2]環加成反應也可以製取環丁二烯的衍生物:以2,3,4,5-四苯基環戊-2,4-二酮作為捕獲試劑,脫羰基後產物之一是環辛四烯的衍生物。...
(1)加成反應 環烯烴性質類似烯烴,雙鍵容易發生加氫、加鹵素、加鹵化氫和加硫酸等反應。(2)氧化反應 環烯烴的雙鍵也容易被高錳酸鉀或臭氧氧化而斷裂生成開鏈的...
