基本介紹
- 中文名:分子軌道對稱守恆原理
- 外文名:conservation of molecular orbital symmetry
- 意義/價值:微觀化學反應動力學的里程碑
- 人物:R.B.伍德沃德
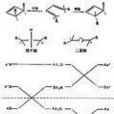
分子軌道對稱守恆原理 conservation of molecular orbital symmetry,principle of 在協同反應中,反應循著保持分子軌道對稱不變的方式進行。若在協同反應過程中自始至終...
這方面的進展是巨大的,例如群論在化學中的套用,能級相關圖、分子軌道對稱守恆原理等的評述。此外,建立在單電子能級和軌道近似基礎上的理論計算方法已發展起來,如自由...
軌道理論,簡稱FMO),Woodward和Hoffmann(分子軌道對稱守恆原理)等眾多科學家的不斷探索,形成了一套成熟的理論,與價鍵理論(VB)和配位場理論(LF)一樣解決分子結構...
根據軌道對稱性守恆原理,在化學反應中,當反應物與產物的軌道自對稱性相吻合時,或者是一個分子的最高已占軌道和另一分子的最低占軌道的波函式符號相同時,反應的...
由於分子內遷移是符合分子軌道對稱守恆原理的反應,因此形成新的鍵時,必須發生的是同位相的重疊。以遷移為例,則為了滿足對稱性的要求,基態時,單占軌道對鏡面對稱,...
著名的分子軌道對稱守恆原理也可藉助於前線軌道理論加以闡明。必須指出,前線軌道理論不僅適用於π軌道,也適用於σ軌道,因此它在有機化學、無機化學,以及表面吸附與...
在反應活性研究方面,FEMO 與LCAOMO 相比成效甚微,仿效著HMO 套用FEMO 的統一相關圖,表述了分子軌道對稱守恆原理,引入自由電子超離域指標,合理地處理了親電芳香取代...
1981年,霍夫曼因為通過分子軌道對稱守恆原理來解釋化學反應的發生而與福井謙一分享諾貝爾化學獎。分子軌道對稱守恆原理是憑藉軌道對稱性來判斷周環反應產物立體化學性質...
分子軌道對稱守恆原理(伍德沃德-霍夫曼規則),是憑藉軌道對稱性來判斷周環反應產物立體化學性質的一套規則,由羅伯特·伯恩斯·伍德沃德和羅德·霍夫曼於1965年提出。它...
軌道,一個是能量比原子軌道低的成鍵軌道,另一個是能量比原子軌道高的反鍵軌道。周環反應分子軌道對稱守恆原理 原子軌道組合成分子軌道時,遵守軌道對稱守恆原理。即...
σ遷移反應符合分子軌道對稱守恆原理,是協同反應的一種,也就是說原有σ鍵的斷裂,新σ鍵的生成,以及π鍵的轉移都是經過環狀過渡態協同一步完成的。...
·霍夫曼聯手,結合大量的實驗事實對狄爾斯-阿爾德反應和相關周環反應的立體化學做了透徹的理論研究,最終導致了在當時震撼了整個有機化學界的“分子軌道對稱守恆原理...
絕對反應速率理論和分子軌道對稱守恆原理,都是量子化學套用到化學反應動力學所取得的成就。今後,量子化學在其他化學分支學科的研究方面將發揮更大的作用,如催化與表面...
·霍夫曼聯手,結合大量的實驗事實對雙烯加成反應和相關周環反應的立體化學做了透徹的理論研究,最終導致了在當時震撼了整個有機化學界的“分子軌道對稱守恆原理”的...
福井謙一提出的前線軌道理論以及伍德沃德和霍夫曼提出的分子軌道對稱守恆原理的建立是量子化學的重要發展。物理化學還在不斷吸收物理和數學的研究成果,例如70年代初,...
逆反應稱螯變消除反應,其驅動力常常是氣態產物導致的熵增優勢。螯變反應與逆反應都是立體專一反應,都遵守分子軌道對稱守恆原理。常見的螯變反應是1,3-丁二烯與...
專長物理化學和高分子物理化學,特別是量子化學。有分子內旋轉、高分子化學反應統計理論、配位場理論、分子軌道圖形理論及分子軌道對稱守恆原理等研究成果,均受到國家...
·霍夫曼聯手,結合大量的實驗事實對狄爾斯-阿爾德反應和相關周環反應的立體化學做了透徹的理論研究,最終導致了在當時震撼了整個有機化學界的“分子軌道對稱守恆原理...
1965年,美國化學家羅伯·伍德沃德(Rober B.Woodward)與霍夫曼參照福井謙一的前線軌道理論,提出了分子軌道對稱守恆原理。分子軌道理論得到了新的發展。 [2] ...
·霍夫曼聯手,結合大量的實驗事實對狄爾斯-阿爾德反應和相關周環反應的立體化學做了透徹的理論研究,最終導致了在當時震撼了整個有機化學界的“分子軌道對稱守恆原理...
反應中沒有中間體生成。協同反應遵守分子軌道對稱守恆原理,即反應物和產物的分子軌道對稱性在反應過程中是守恆的。周環反應就是一類重要的協同反應。...
