簡介
丁二烯的順旋環化和Diels—Alder反應這樣的協同反應或基元反應,它們在基態時各有關的分子軌道具有適當的對稱性,可以互相匹配形成能量較低的過渡狀態,有利於反應的進行,這種反應稱為對稱允許的反應。反之,像丁二烯的對旋環化和[2+2]環加成反應,則稱為對稱禁阻的反應。
這裡的“允許”與“禁阻“,只表示一個基元步驟或協同過程的難易程度。一個對稱禁阻的反應,並不是不能發生,而是表示其在基態時,不能按協同機理進行,它需要較高的
活化能,但可以在激發態仍按對稱允許的協同途徑進行,或者通過非協同的機理髮生。
判斷標準
前線分子軌道理論要點:前線分子軌道指的是分子最高占據軌道(HOMO)和最低空軌道(LUMO)。前線分子軌道理論的要點如下。
1、進行化學反應時起決定作用的軌道是一個分子的HOMO和另一個分子的LUMO。
2、
前線軌道之間發生作用時,一個分子的HOMO與另一個分子的LUMO必須對稱性一致,即按軌道正與正、負與負同號重疊,以致使兩個軌道產生淨的有效重疊。
3、HOMO與LUMO的能量必須接近(約6eV)。
4、電子密度從一個分子的HOMO轉移到另一個分子LUMO,轉移的結果必須與反應過程中舊鍵斷裂、新鍵生成相適應。
服從上述4點的反應稱為對稱允許的反應,反之稱為對稱禁阻的反應。一個對稱允許反應通常對應低活化能,對稱禁阻的反應則需要高活化能。
軌道能量圖繪製
前線分子軌道原理認為反應物和產物的分子軌道對稱性相同時,即反應前後和反應過程中分子軌道對稱性保持不變,反應容易進行,稱為對稱允許的反應;不相同時反應難以進行,稱為對稱禁阻的反應。它考慮的是反應物與產物的全部分子軌道,不只是前線分子軌道。首先必須分析反應物、產物分子軌道的對稱性,然後找出在反應前後和過程中都起作用的對稱元素,即對稱性不改變的對稱元素。
確定某一反應方式的有效對稱元素後,即繪出軌道能量相關圖。其步驟為:
①把反應物和產物的分子軌道按能量高低順序排列在兩邊;
②由於反應物轉化為產物的過程中分子軌道對稱性應維持不變,因此把反應物和產物對稱性相同、能量相近的分子軌道用關聯線連線;
③對稱性相同的關聯線不能相交,這樣就得到分子軌道能量相關圖。
根據能量相關圖,如果由反應物轉化為產物需要較低的活化能,則在加熱條件下就可以完成反應;如果需要電子激發才可以轉化為產物,活化能較高,在光照條件下才能完成反應。
對稱禁阻反應的催化
不少對稱禁阻的
周環反應,可以在過渡元素的
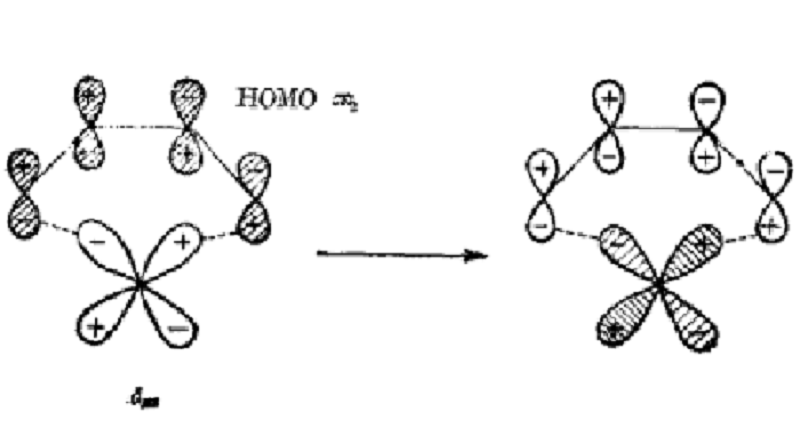
催化作用下發生,這被稱為對稱禁阻反應的催化。對於催化劑的作用方式,曾有幾個推測性的建議。其中最有趣的是Mango於1967年研究[2+2]環加成反應時提出的機理:有機分子作為配位體被過渡金屬絡合後,它的HOMO和LUMO分別與金屬提供的具有正確對稱性的空軌道和占有軌道相互作用,使有機分子能夠有效地把電荷密度從HOMO轉移到LUMO中。這樣有機分子本身由基態變成了激發態,以致原來是對稱禁阻的反應成為對稱允許的反應。事實上,這個處理方法本身是前線軌道理論和軌道對稱守恆原理的一個套用。
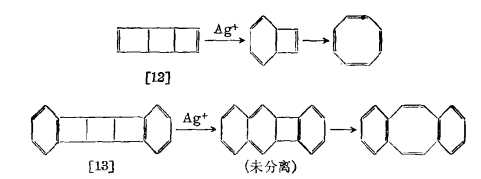
對稱禁阻催化電環化反應的典型例子是有張力的環丁烯衍生物的開環反應。由於體系的立體化學,這些反應必是對旋開環,作為協同過程其熱反應是不允許的。雙環[3,2,0]-庚烯在高溫下能緩慢對旋開環,反應在銀離子等存在下能大大加速。同樣地,稠合環丁烯類[12][13](如下圖)等容易熱重排也包括環丁烯的對旋開環。在亞銅鹽或銀鹽的作用下,室溫時反應能瞬息完成,活化能從非催化反應的23千卡·摩爾-1減少到約8千卡·摩爾-1。
 反應方程式
反應方程式 反應方程式
反應方程式