適用範圍
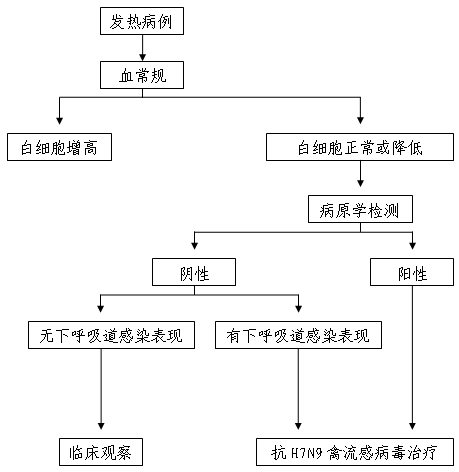
本標準規定了流感的診斷標準及處理原則。
本標準適用於各級各類醫療、衛生、保健機構和人員對流感的診斷、報告和處理的套用。
診斷原則
流感流行時一般根據臨床症狀、結合流行病學可對病人作出初步診斷。如確定診斷則需要分離病毒陽性或病人雙份血清抗體,測定恢復期抗體較急性期增高4倍或以上。
臨床症狀
⒊2.1,出現急起畏寒、
高熱、頭痛、頭暈、全身酸痛、乏力等中毒症狀。
⒊2.2,可伴有
咽痛、乾咳、流鼻涕、流淚等呼吸道症狀。
⒊2.3,少數病例有
食慾減退,伴有腹痛、腹脹、嘔吐和腹瀉等消化道症狀。
⒊3,實驗室診斷
⒊3.2,從病人鼻咽分泌物分離到流感病毒(見附錄A)。
⒊3.3,恢復期病人血清中抗流感病毒
抗體滴度比急性期有4倍或4倍以上升高(見附錄B)。
⒊3.4,直接檢查呼吸道
上皮細胞的流感病毒抗原陽性(見附錄C中C1)。
⒊3.5,標本經敏感細胞增殖1代後查抗原陽性(見附錄C中C2)。
病例分類
具備3.1加3.2或3.1加3.2加3.3.1。
疑似病例加3.3.2或3.3.3或3.3.4或3.3.5。
4,處理原則
⒋1,早期隔離病人、對症治療病人和防治合併症
早期發現病人、早期隔離病人是最重要的措施。對病人治療一般採用對症治療。防治併發症主要應防止
流感病毒性肺炎和
細菌性肺炎,特別是對年老體弱者或伴有心血管、慢性
呼吸道疾病者或嬰幼兒,流感本身或其合併症可能引起死亡,應特別注意加強治療護理。
⒋2,預防措施
一般採用綜合性預防措施,講究衛生,注意體格鍛鍊和營養,保持室內空氣流通;對易感人群應採取相對隔離措施,如避免接觸病人,不去公共場所等;對年老體弱者必要時可採用
滅活疫苗接種或服用
金剛烷胺等預防方法(但須注意金剛烷胺僅對防治甲型流感有效)。
診斷標準
流行病學史
在流行季節一個單位或地區同時出現大量
上呼吸道感染病人;或近期內該地區或鄰近地區上呼吸道感染病人明顯增多;或醫院門診上呼吸道感染病人明顯增多。
病原學診斷方法
A1 病毒分離
從疑似流感病人呼吸道採集標本分離病原體。
A2 標本的收集和處理
A2.1 標本收集時間應於發病早期(1~3d內)越早越好。
A2.2 標本收集方法常用棉拭子擦抹法或咽喉漱洗法。棉拭子擦抹法用於採集兒童標本,採集時將滅菌棉拭子稍沾標本收集液(pH7.2~7.6含20%~40%滅菌肉湯的
生理鹽水或Hanks液或生理鹽水),反覆擦拭患者咽部數次,然後將此棉拭子放進裝有上述收集液的試管中塞上棉塞。咽喉洗漱法用於採集成人標本,採集時先讓患者咳嗽,然後用10mL左右的收集液反覆洗漱咽喉部約1min,吐入管內。如有條件,兒童標本用負壓抽吸法抽取鼻咽分泌物,成人標本用鼻咽洗液,可提高分離的陽性率。標本採集後置冰壺(4℃)中儘快送實驗室。
A2.3 標本的處理:用毛細吸管反覆吹打標本液(如為咽拭子標本,先反覆擠壓
咽拭子後棄之),將粘液打散,於4℃靜置5~10min,待自然沉澱後取3mL上清,按每毫升加
青黴素1000單位和鏈黴素1000μg,混勻置4℃處理2~4h即可接種。如標本污染較重,可置4℃過夜處理。如預計標本在48h內不能完成接種時,應將標本置低溫(最好-70℃)保存。
A3 接種及培養法
A3.1 雞胚培養法:取9~11日齡
雞胚,將處理過的標本液經
羊膜腔和尿囊腔各接種0.2mL,每份標本接種3~4隻胚,置33~35℃溫箱培養3d,然後將雞胚放置4℃冰櫃過夜(或置—20℃冰櫃1h再置4℃數小時)可分別收穫尿液和羊水,並作初步血凝(其方法是用毛細吸管取1~2滴尿液或羊水,置大孔
塑膠板內,再加入1~2滴1%雞紅細胞,搖勻後置室溫或4℃30~45min觀察結果,根據血球凝集程度的不同可分為++++、+++、++、+、±、-),如血凝為+++~++++時,再按系列倍比稀釋測定其血凝滴度,如具有一定血凝滴度即可鑑定。如血凝陰性,可盲傳2代,如仍為陰性則棄之。
A3.2 組織培養法:用0.2mL處理過的標本液接種於長成單層的原代人胚腎(或猴腎或地鼠腎),或狗腎傳代細胞(Madin Darby Canine Kidney,MDCK),每份標本接種4管,置37℃吸附1~2h後棄標本液,再加入每毫升含2μg
胰酶的199維持液1mL,於33℃培養7~10d,並逐日觀察病變。從第三天開始每隔一天用0.4%雞或
豚鼠紅細胞對培養管做紅細胞吸附試驗(試驗前無菌法收穫細胞培養上清液),如陰性則用已收穫的上清液盲目傳代,如陽性則測定上清液的血凝滴度。如標本第1代紅細胞吸附試驗陰性,可用收穫的全部上清液混合進行盲傳2代,仍為陰性則棄之。
A4 新分離株的鑑定
A4.1 血凝抑制試驗:用當前流行的甲3、甲1及
乙型流感病毒代表株的
免疫血清與新分離流感病毒做血凝抑制試驗,觀察新分離株能否被免疫血清所抑制。血凝抑制試驗方法見附錄B。
A4.2 紅細胞吸附抑制試驗:取紅細胞吸附試驗陽性的組織培養管和正常細胞對照管,用Hanks液洗細胞2次,加入經
霍亂濾液(RDE)處理(1∶10)的免疫血清0.2mL,再加入Hanks0.6mL,室溫作用30min後,再加入0.4%雞(或
豚鼠)紅細胞0.2mL,置室溫30min後於普通光學顯微鏡下觀察有無血球吸附。如果
血細胞吸附被所用
免疫血清所抑制,表明所分離的病毒與所用免疫血清型別相一致或接近。
A4.3
補體結合試驗:如果用已知的甲型(甲3、甲1)或乙型或丙型流感病毒免疫血清對新分離病毒的血凝均不能抑制,則應考慮可能為
甲型流感病毒的新亞型,可用針對甲型、
乙型流感病毒核蛋白的免疫血清作補體結合試驗定型。
B1.1 原理
一些動物紅細胞(如雞、
豚鼠等)以及人“O”型血紅細胞上有流感病毒受體,遇流感病毒可產生紅細胞凝集現象,簡稱血凝。若將特異性抗體與流感病毒(
血凝素)預先作用後再加入紅細胞則不產生凝集,稱為血凝抑制現象。用定量血凝素與不同
稀釋度血清抗體作用後,能完全抑制血凝的最高稀釋度,即為血凝抑制抗體
效價。
B1.2 主要材料
B1.3 雙份血清收集及處理
急性期血清於發病3d內採取,恢復期血清於發病後2~4周採取。取0.1mL已分離的血清加入0.9(或0.4)mL
霍亂濾液(RDE)(即1∶10或1∶5稀釋)搖勻,於37℃水浴中過夜,以去除血清中的非特異性抑制素,次日置56℃水浴50min以滅活多餘的RDE。
流感病毒接種
雞胚後48h收穫的尿囊液,加入1/10000
硫柳汞防腐。為了延遲尿鹽沉澱可先用無菌
生理鹽水做等量稀釋,置4℃備用。
從靜脈或心臟抽取正常健康雞血,保存於阿氏(Alsevr's)液中,置4℃保存。用前以生理鹽水洗3次,末次經2000r/min離心10min,將紅細胞用生理鹽水配成1%濃度。
B1.6 血凝素滴定
將流感病毒血凝素在大孔
塑膠板內用生理鹽水從1∶5開始做系列倍比稀釋,每孔0.25mL再加入等量1%雞紅細胞,搖勻,置室溫或4℃30~45min後觀察結果,以出現十十血凝的
血凝素最高
稀釋度為其血凝
效價,即為1個血凝單位,實驗時採用4個血凝素單位,例如血凝素效價為1∶320,為1個單位,4個單位即為1∶80稀釋。正式實驗前經校對取4個血凝單位用於實驗。
B1.7.1 將上述已處理的待檢血清(1∶10或1∶5)再用
生理鹽水做系列倍比稀釋,每孔加0.25mL。
B1.7.2 加入等量已配好的4個單位血凝素。
B1.7.3 每孔加入0.25mL 1%雞紅細胞,搖勻置室溫或4℃30~45min。
B1.8 結果觀察
觀察結果時將血凝板傾斜數十秒鐘,待陰性孔內紅細胞自由下滑呈淚滴狀時讀結果。以出現完全抑制的血清最高
稀釋度的倒數為抗體的
效價。在檢測患者雙份血清時需在同一次試驗中進行,並以恢復期
血清抗體效價較急性期
抗體效價升高4倍或4倍以上為陽性。
B2.1 原理
B2.2.1 免疫用抗原
甲型為PR8株和乙型為Lee株均為小鼠適應株。於
乙醚麻醉下鼻腔感染12~16g小鼠,每鼠0.05mL,待感染後3~5d大部分小鼠發病、部分死亡時,解剖小鼠。取肺研磨並用
生理鹽水製成10%的懸液,低速離心去除粗塊,取上清鼠肺懸液即為免疫用抗原。
B2.2.2 免疫血清製備
選體重300~500g的健康
豚鼠,免前採血3~5mL,分離血清分裝凍存留作對照。豚鼠用乙醚輕度麻醉,鼻腔滴入上述鼠肺懸液抗原0.5mL,共免疫3~4次,每次間隔一周,在末次免疫的同時,由
腹腔注射鼠肺懸液2mL,一周后試血,如果對同型尿膜抗原的血清
效價超過1∶80,而與異型抗原無
交叉反應,立即採血分離血清分裝凍存於低溫(-20℃以下)。試驗前血清於56℃水浴滅活30min。
B2.3 可溶性抗原的製備
用甲、乙型流感病毒或新分離病毒按常規接種和收穫尿囊液,如尿液血凝在1∶40以上時,收穫其尿囊膜,將尿囊膜用鹽水洗一次,用無菌剪刀將膜剪成數小塊放入試管中,每個
雞胚的尿囊膜加1mL無菌
生理鹽水,凍化三次,末次化後以3000r/min離心15min,吸出上清即為
可溶性抗原,加入1∶10000的
硫柳汞防腐,置4℃冰櫃至少可用一個月。
B2.4 雙份血清採集
收集病人急性期(發病3d內)和恢復期(發病10~30d後)的血清。血清於試驗前56℃30min滅活。
按常規進行。
B2.7 結果判定
B2.7.1 被檢病毒尿膜抗原與甲型(或乙型)
流感病毒免疫血清呈陽性反應則可診斷為甲型(或乙型)流感病毒,如甲、乙均為陰性時,應考慮丙型流感病毒或其他病毒。
B2.7.2 雙份血清對甲型(或乙型)抗原有4倍或4倍以上升高,即可診斷為甲型(或乙型)流感病毒感染。
B2.7.3 正常人群補體結合抗體滴度一般在1∶16以下,如單份恢復期
血清抗體在1∶32以上時,結合臨床症狀可作診斷的參考。
B2.7.4 人群血清抗體水平調查中,補體結合抗體在1∶32以上者可作為新近感染流感的證據。
B3.1 原理
胎球蛋白(Fetuin)底物經流感病毒的
神經氨酸酶作用後,使N
乙醯神經氨酸游離出來,經過
碘酸鹽的
氧化作用將N乙醯神經氨酸轉化為β-
甲醛內
酮酸,後者經硫代
巴比妥酸作用形成
生色團,用有機溶劑提取生色團,並在
分光光度計上比色。利用上述反應可測知流感病毒的神經氨酸
酶活性,反應的顏色越深酶活性越強。並可選擇用於神經氨酸酶抑制試驗的標準劑量。神經氨酸酶抑制試驗是將標化好劑量的神經氨酸酶(即一定
稀釋度的流感病毒尿囊液)和系列稀釋的被檢血清和正常血清起孵育,測知血清作用於神經氨酸酶活性的抑制
效價,並計算出血清的
神經氨酸酶抑制
滴度。
B3.2 器材及試劑
B3.2.1 小試管、10mL吸管及分光光度計等。
B3.2.3 胎球蛋白底物液:450~500mg冰凍乾燥的胎球蛋白加
蒸餾水10mL,溶解後置4℃保存,每周新配。
B3.2.4 過
碘酸鈉溶液:稱4.8g過碘酸鈉(NaIO(下標始)4(下標終))溶於38mL蒸餾水中,加62mL正磷酸(濃),充分混合,置於棕色磨口瓶中,室溫保存。
B3.2.5
砷試劑:稱10g
砷酸鈉(NaAsO(下標始)2(下標終))和7.1g無水硫酸鈉溶於100mL蒸餾水中,加0.3mL
濃硫酸,置於帶玻璃塞的瓶中,置4℃保存。
B3.2.6 硫代
巴比妥酸試劑:稱1.2g硫代巴比妥酸和14.2g無水硫酸鈉加入200mL蒸餾水中,在煮沸的水浴中加熱溶解,每周新配。
B3.3.1 病毒用
生理鹽水做系列倍比稀釋(1∶2~1∶32)分裝小試管,每管0.1mL。標準病毒和未知病毒的
神經氨酸酶應在同一試驗中測定。
B3.3.2 每管補充加入0.1mL生理鹽水,再加入0.1mL用pH5.9 PBS配製的胎球蛋白底物,對照管用鹽水代替病毒,充分混合後置37℃水浴作用18h。
B3.3.3 從水浴中取出試管在室溫冷卻,每管加入0.1mL的過
碘酸鹽試劑,充分混合,室溫靜置20min(時間要準)。
B3.3.4 每管加入1mL
砷試劑,由於碘的釋放出現棕色,搖動試管待棕色消失。
B3.3.5 每管加入2.5mL硫代
巴比妥試劑,並充分混合(該試劑需在煮沸溶解後加入),用棉塞將管口堵緊。
B3.3.6 立刻將試管置於煮沸的水浴中,煮沸10min,可見紅色出現,即為神經氨酸酶活性的表現,顏色越深酶活性越高。
B3.3.7 將試管置冰水中冷卻後去掉棉塞,加入4mL
丁醇試劑,換上乾淨橡皮塞,用手劇烈搖動試管,提取顏色使其轉到有機物(丁醇)相。
B3.3.8 以1500r/min離心5~10min使丁醇層清亮透明,小心地吸出上層的丁醇,放入乾淨的試管中待檢。
B3.3.9 將上述受檢樣品由高稀釋度到低稀釋度依次傾入透光池中,其中第一個透光池加入無病毒的對照管液,將
分光光度計波長調至549nm,將對照管調至零,然後依次讀取每個
稀釋度樣品的
光密度。
B3.3.10 酶單位的計算:
酶活性測定時光密度為0.45~0.85的病毒稀釋度作為一個酶單位。
B3.4.1 按上述方法測定酶活性,選用1個酶單位的病毒稀釋度(即酶活性測定時光密度為0.45~0.85的病毒稀釋度),每管加入0.1mL。
B3.4.2 受檢血清做系列倍比稀釋,每管病毒加入不同
稀釋度血清0.1mL,血清對照管是以最低稀釋度血清加
生理鹽水代替病毒,37℃水浴作用1h。以同法做正常血清對照組。
B3.4.3 每管加入pH5.9 PBS配製的胎球蛋白0.1mL,充分搖勻,置37℃水浴中孵育18h。
B3.4.4 自水浴中取出試管,按B3.3.3.~B3.3.7逐步加入前述各種試劑。
B3.4.5 測定
光密度時應從低稀釋度血清管至高稀釋度血清管,檢測方法同B3.3.9。
B3.5.1 根據
抗血清和正常血清兩組試驗的實驗結果,求得每組血清同一
稀釋度的光密度之商數,即為經血清作用後所余之
酶活性的百分數。血清稀釋度越高,殘留的酶活性也越高,找出50%酶活性前後兩個血清稀釋度及其相應的酶活性百分數,按公式計算出血清神經氨酸酶抑制抗體滴度。
B3.5.2 計算公式
B(下標始)1(下標終)——酶活性高於50%的血清稀釋度倒數;
B(下標始)2(下標終)——酶活性低於50%的血清稀釋度倒數;
C(下標始)1(下標終)——高於50%的酶活性的百分數;
C(下標始)2(下標終)——低於50%的
酶活性的百分數;
50——常數。
B3.5.3 計算舉例
先計算血清作用後的酶活性:
然後將
對數稀釋度換算為幾何稀釋度:例如10(上標始)-3(上標終)換算為1/1000,10(上標始)-3.5(上標終)換算為1/3200。最後代入公式:
流感快速診斷方法
C1.1 原理
由於流感病毒的主要感染部位是在呼吸道上皮細胞,因此在病人呼吸道標本的
脫落細胞中含有流感病毒抗原,通過直接檢查脫落上皮細胞內抗原即可診斷。檢查方法可採用
免疫螢光法,一般於3~4h內即可完成,而且可以直接定型。
C1.2 標本的收集和製片
兒童標本最好採用負壓抽吸法收集呼吸道分泌物,成人標本最好採用鼻咽洗液。可將每份標本分為兩份,一份低溫凍存備作病毒分離,一份用pH7.2
磷酸緩衝液(PBS),將粘液吹打散,1500r/min離心15min去除上清,細胞沉澱用PBS洗1~2次,末次離心後棄上清,加入適量pH7.2 PBS使細胞重懸,滴加於帶圈的玻璃片上,自然乾燥,冷
丙酮固定10min。
C1.3 間接免疫螢光法
C1.3.1 用10%新鮮羊或牛血清封閉標本片,置濕盒中於37℃30min。
C1.3.2 分別加入適當稀釋度的抗甲型和乙型流感型特異性單克隆抗體,置濕盒中於37℃放置1h。在PBS中洗兩次,共10min。
C1.3.3 加適當稀釋度的兔抗鼠
螢光素結合物置37℃1h。在PBS中洗三次,共10min,末次用
蒸餾水過一下。
C1.3.4 於
螢光顯微鏡下觀察結果,觀察到三個以上
胞漿內或胞核內
螢光陽性細胞即可判為陽性。
C2 標本經敏感細胞增殖1代後查抗原
C2.1 原理
病人呼吸道標本經接種敏感細胞(狗腎
傳代細胞MDCK)增殖1~3d後,將細胞消化分散製成抗原片,再用
免疫螢光法或免疫酶染法檢查細胞內抗原。由於標本中的病毒在敏感細胞增殖後查抗原,能明顯提高其診斷的敏感性,可在細胞病變出現以前查到抗原,可以直接定型,而且比常規
雞胚分離病毒法要快得多,一般24~72h即可診斷。檢查方法可採用間接免疫酶染法(C2.5)或間接免疫螢光法(C2.4)
C2.2 標本的收集及處理
兒童標本可採用
咽拭子,最好採用負壓抽吸法;成人標本可採用咽漱液,最好採用鼻咽洗液。標本按附錄A(標準的附錄)中A2.3方法處理。
C2.3 標本的接種培養及製片
取處理過的標本液0.2mL接種於長成單層的MDCK細胞,每份標本接種3管,置37℃吸附1~2h後棄去標本液,加入每毫升含2μg
胰酶的199維持液至1mL,於35℃培養24、48和72h分別取出1管,收集上清備用,將細胞用
消化液(1份0.25%胰酶+4份Versene)消化下來,用PBS洗一次,然後滴加於帶圈的玻璃片上,
自然乾燥,冷
丙酮固定。同法製備未經感染的正常MDCK細胞片即為正常對照細胞。
C2.4 間接免疫螢光法
C2.4.1 加單克隆抗體同C1.3.2。
C2.4.2 加兔抗鼠
螢光素結合物同C1.3.3。
C2.4.3 於
螢光顯微鏡下觀察結果,觀察到
胞漿內或胞核內螢光,而正常細胞片未見螢光,即可判定為陽性。
C2.5 間接免疫酶染法
C2.5.1 加單克隆抗體同C1.3.2。
C2.5.2 加適當稀釋度的羊抗鼠酶標結合物,濕盒中置37℃1h,用PBS洗兩次10min。
C2.5.3 加
鄰苯二胺底物液,其配製方法為:4mg鄰苯二胺+10mLpH5.0磷酸-
檸檬酸緩衝液+15μL雙氧水。pH5.0
磷酸緩衝液的配製方法為:先分別配製0.1mol/L檸檬酸(C(下標始)6(下標終)H(下標始)8(下標終)O(下標始)7(下標終)·H(下標始)2(下標終)O)(21g/1000mL)和0.1mol/L
磷酸氫二鈉(Na(下標始)2(下標終)HPO(下標始)4(下標終))(28.4g/1000mL),分別按24.3mL和25.7mL混合後,再加入等量(50mL)雙蒸水混合即為pH5.0
磷酸鹽-檸檬酸緩衝液。加入底物液3~5min即可觀察結果。
C2.5.4 於
倒置顯微鏡下觀察結果(觀察結果時,細胞要濕,如果細胞已乾,可以加入一滴自來水),觀察到棕紅色深染細胞,根據觀察到的深染細胞多少記錄為++++、+++、++、+、±、-。以觀察到+以上深染細胞判為陽性;有時可觀察到單個深染細胞被無色或淡紅色細胞所包圍,而
正常細胞對照呈無色或淡紅色,亦可判為陽性。