基本介紹
- 中文學名:水皰性口炎病毒
- 拉丁學名:Vesicular stomatitis virus Latin
- 科:彈狀病毒科
- 形態:病毒粒子為子彈狀或圓柱狀
病原學特徵,傳播及致病機理,臨床症狀,流行情況,診斷方法,疫苗免疫及預防,
病原學特徵
1.1 病毒形態及理論化特性
VSV為彈狀病毒科(Rhabdoviridae)、水皰病毒屬?(Vesiculovirus)的成員,病毒粒子為子彈狀或圓柱狀,長度約為直徑的3倍,大小為150~180 nm×50~70 nm。病毒有囊膜,囊膜上均勻密布有長約10 nm的纖突。病毒內部為緊密盤旋的螺旋對稱的核衣殼。彈狀病毒的RNA無感染性,病毒的核衣殼具有感染性,採用DEAE?dextran或磷酸鈣可提高核衣殼的感染性。由於VSV相對簡單的結構、較高的複製能力、快速的疾病過程,所以被廣泛的套用於研究RNA進化的模型。〖JP〗VSV粒子分子量為 265.6×103±13.3×103 kD。其中蛋白質占74%,類脂質占20%,糖類占3%,RNA占3%。VSV對理化因子的抵抗力與口蹄疫病毒(FMDV)相似,56℃ 30 min、可見光、紫外線及脂溶劑(乙醚、氯仿)都能使其滅活。該病毒可在土壤中於4~6℃存活若干天。對石炭酸能抵抗23天,0.05%結晶紫可使其失去感染性,不耐酸。
1.2 基因結構特性
VSV基因組為不分節段的單股負鏈RNA(ssRNA)病毒,長約11 kb。從3′端→5′端依次排列著N、NS、M、G、L 5個不重疊的基因,分別編碼核(N)蛋白、磷酸(P)蛋白、基質(M)蛋白、糖(G)蛋白、及RNA聚合酶(L)蛋白等5種不同的主要蛋白。N基因的3′端有不翻譯的先導序列,5′端有非翻譯區,各基因間有間隔序列。先導RNA在感染細胞中是最早的病毒轉錄物。為47 nt,它既不戴帽,也不翻譯,其功能尚未完全清楚,可能是抑制宿主RNA的合成。N基因為1 333 nt,編碼病毒核(N)蛋白,核蛋白分子由422個胺基酸殘基組成,分子量為47 kD。每個病毒粒子含有1 258個拷貝,它可有效的保護病毒RNA免受各種核酸酶的消化。N蛋白呈群特異性,為許多型和亞型所共有,有高的抗原性,刺激機體產生非中和抗體,且在轉錄複製中擔任了重要的角色,它對維持基因組RNA呈伸展形式可能是需要的,與複製調節有關;NS(P)基因為822 nt,編碼磷酸蛋白,磷酸蛋白分子由222個胺基酸殘基組成(VSV-NJ由274個殘基組成,與Indiana病毒株的同源性為41%),每個病毒粒子含有466個拷貝。NS基因呈高度不均一的磷酸化。由NS、L、N蛋白-RNA複合物對轉錄酶活性的發揮是必需的;M基因為838 nt,編碼基質蛋白(位於包膜內側面),由229個胺基酸殘基組成,分子量為26 kD,每個病毒粒子含有1 826個拷貝, 不糖基化。
作為一種連線蛋白(使核衣殼與鑲有糖蛋白的脂質膜接觸),它使與插有G蛋白的細胞漿膜接觸。M蛋白鹼性較強,可通過與核衣殼結合而抑制轉錄,同時對VSV的出芽過程是必不可少的。它是涉及出芽過程的惟一多肽,可以說,M蛋白的合成對VSV的成熟是必需的;G基因為1 672 nt,編碼糖蛋白,VSV-IN由511個胺基酸殘基組成,分子量為57 kD,每個病毒粒子含有1 205個拷貝。G蛋白上含有2個糖基化位點,是病毒的主要表面抗原,決定著病毒的毒力,也是病毒的保護性抗原。它可刺激機體產生中和抗體,呈現型、亞型,乃至株的特異性。G蛋白在病毒吸附在宿主細胞中以及病毒從宿主中出芽釋放起到了重要作用,與病毒吸附到宿主細胞受體有關的病毒成分是糖蛋白。當選擇性的蛋白溶解以去除VSV糖蛋白時,便會降低病毒的感染性,並且抗糖蛋白的抗體能有效的中和該病毒。L基因為6 380 nt,編碼RNApolyE蛋白,由2 109個胺基酸殘基組成,分子量為241 kD,每個病毒粒子含有50個拷貝。它可能決定RNA的轉錄活性。L蛋白涉及起始、延伸、甲基化、戴帽、聚(A)尾形成等等。在基因之間間隔2或3個核苷酸的間隔序列有廣泛的同源性,這些序列有一個共同的結構,即3-AUAC(U) 7NAUUGUCNN-UAG-5。這些基因之間的保守序列是一種關鍵信號,以影響多聚酶的活性或酶的切割活性,而在複製過程中,這些信號被掩蓋,不起作用。
1.3 培養特性
VSV在大多數脊椎動物、鳥類、爬行動物、魚類及昆蟲的細胞培養上可以生長。一般說來,VSV屬的病毒在感染脊椎動物細胞後,可以很快引起明顯的細胞病變,18~24 h即可引起細胞快速圓縮、脫落,在動物的原代腎細胞單層產生不同大小的蝕斑。而感染昆蟲細胞則引起持續性感染,無細胞病變。?
VSV繁殖的兩個顯著特點為:複製期短和高的自發變異。一般說來,VSV屬的病毒在感染脊椎動物細胞後,可以很快引起明顯的細胞病變(18~24 h)。而且平均在每個複製周期中,每個核苷酸約有10-3~10-5替代率。病毒的基因複製有出錯傾向,導致了很多變異株的產生。?
VSV在細胞中若以高複製數傳代時,易產生DI顆粒(Defective Interfering particles,缺陷性干擾顆粒),對親本病毒的複製產生干擾現象。DI顆粒可快速成為主要的顆粒,競爭複製的病毒只有通過變異才能抵制DI顆粒的干擾。因此,可以認為DI顆粒至少在細胞培養中,推動了病毒粒子的進化演變。為了防止DI顆粒,傳代時應以低"感染複數"傳代(MOI=0.01),還應儘可能減少傳代次數。
1.4 血清型及亞型
VSV迄今為止有14個病毒型,在抗原性方面有不同的差異。根據中和試驗和補體結合試驗,可將VSV分為2個血清型,其代表株分別為印第安納(Indiana,IN)株和新澤西(New Jersey,NJ)株。根據抗原交叉反應性又將IN型分為3個亞型,分別為IN1、IN2(Cocal)和IN3(Alagoas)。Nichol等人經過對VSV-NJ(新澤西株)T1核酸酶指紋圖譜的研究及毒株間的進化關係,將NJ型分為至少3個亞型。
 水泡性口炎病毒
水泡性口炎病毒傳播及致病機理
2.1 傳播途徑
VSV 能感染多種動物和昆蟲。家畜中自然感染VSV的有馬、牛(羊)、豬。血清學試驗證明野生動物(野豬、浣熊和鹿等)可以自然感染。在巴拿馬的樹棲和半樹棲動物血液中發現了IND-1型的抗體。在蝙蝠、食肉動物和一些齧齒動物的血清中發現了抗NJ型的抗體。人感染主要見於實驗工作人員和流行地區與家畜接觸的人。?
VS的傳播機制尚不清楚,VSV並不分泌到尿、糞便或乳液中。VSV可通過皮膚破損處的摩擦接觸而感染,但感染並不能發生於上皮細胞完好的諸如齒齦、舌、蹄冠或乳房等處;蚊蟲叮咬、吸乳時乳頭部擦傷的皮膚等均可引起感染。實驗室證明已有5種VSV屬的病毒可通過昆蟲叮咬而感染實驗動物。通過感染的白蛉試驗證明,Indiana、Carajas、Maraba、Chandipura 4種病毒株可經卵傳播。?
病毒可以氣溶膠的形式,通過吸入而感染動物,但不引起典型的損傷症狀。Ratterson, ?.et. al表明VSV可通過“眼部”途徑感染機體。當身著橡膠服裝只有臉部暴露的工作人員與感染VSV的動物接觸而被感染時,結膜炎總是先於其他症狀而出現。然而這種途徑還未在動物上得到有效的證明。?
2.2 致病機理
VSV呈嗜上皮性,一般認為,VSV是通過上皮和黏膜侵入機體的。病毒的表面突起與細胞受體結合,然後囊膜與細胞膜融合進入細胞或直接被細胞吞入,形成吞飲泡,在酸性環境或細胞酶的作用下裂解,釋放核酸,在細胞漿內依賴逆轉錄酶進行大量複製,在細胞膜或胞漿空泡膜上出芽,釋放成熟的病毒顆粒,常聚集細胞間隙,並以同樣的方式再感染相鄰細胞。對於細胞的感染,VSV可快速的關閉細胞的基因表達,阻止其新陳代謝能力,解聚細胞骨架,從而使組織快速破壞。
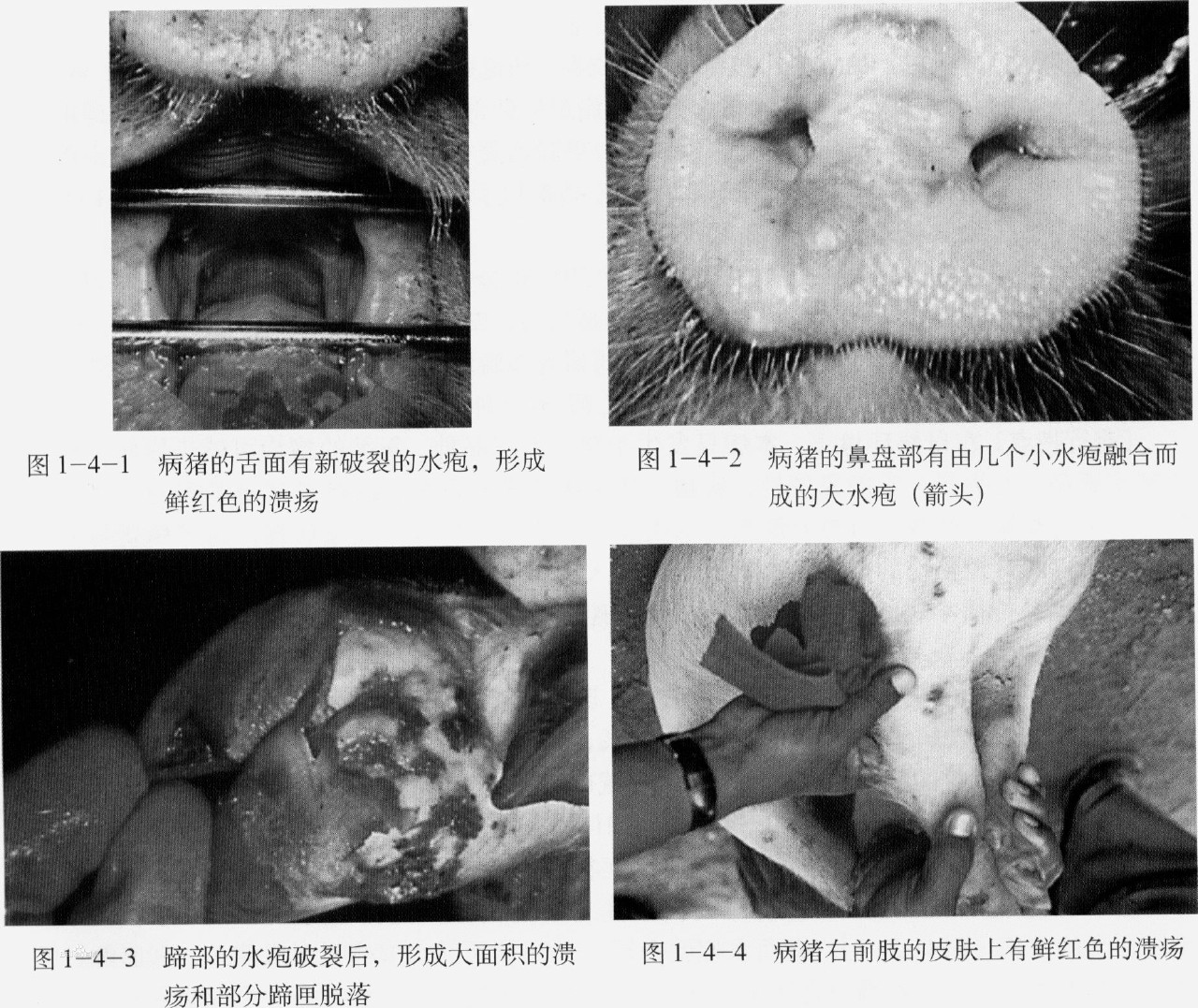
病毒一旦侵入上皮層,即在皮內發生原發病變,同時在較深層的皮膚中,尤其是棘細胞層,病毒的複製更活躍,從病毒複製到引起細胞溶解過程,會有滲出液蓄積,小水泡變成大水泡。VSV感染動物可激發乾擾素的產生和硝酸氧化反應,從而快速的控制病毒的複製,同時血清中的抗體也阻止了病毒的進一步複製。這一階段常在實驗感染2~3天內發生。當病毒擴散到整個生髮層後,常破壞柱狀細胞層和基底膜,但並不明顯破壞這些細胞的再生能力。雖然在真皮和皮下組織中有出血、水腫和白細胞浸潤,但並不造成原發性損傷。如果出現繼發性感染,其損傷可能擴散到深層組織造成化膿和壞死,在無併發症的情況下,上皮細胞迅速再生,通常1~2周康復而不留疤痕。?
病毒於感染48 h後到達血液,引起發熱,病畜體溫可高達40~40.5℃,常可持續3~4天。病毒血症可漸漸消失,但水泡增大,水泡中病毒滴度可高達每毫升10-10感染單位,此後病畜體溫突然下降,病畜大量流涎,感染上皮發生腐爛脫落,出現新鮮出血面,偶爾形成潰瘍。?
VSV-Indiana和NJ的致病性決定於病毒劑量、感染途徑、脊椎動物宿主的種類與年齡等。這兩株病毒接種新生小鼠或地鼠可很快致死,靶器官是肝、腎。但用同樣的病毒皮下或肌肉接種成年的小鼠,小鼠可經受感染而存活,並產生保護性抗體。
VSV-Indiana和NJ毒株腦內或鼻腔內接種實驗鼠,不論鼠齡大小,可引起規律性死亡,產生急性壞死性腦炎。
臨床症狀
VSV-Indiana 、NJ、Cocal和Alagoas具有獸醫上和經濟上的重要性,因為它們可使牛和豬致死。受感染的動物表現為發熱,嗜睡,食慾下降,口腔、乳頭、趾間及蹄冠上出現水皰性病灶和腿部的罐狀環帶。水泡易破裂,露出肉芽組織,呈紅色糜爛,周圍又刮破的上皮,常在7~10天內完全痊癒。由於水皰性口炎而死亡的較少,但是,可造成局部繼發細菌和真菌感染,從而導致跛行、體重下降、出奶下降和乳腺炎,帶來重大經濟損失。?
牛馬豬感染後的潛伏期一般為1~7天,早期表現為發熱、遲鈍、食慾減退、流涎多。繼而出現0.5至數厘米大小的白色至灰紅色水泡,內部充滿黃色液體,通常成群聚集。水泡多見於舌、牙床、鼻和唇,水泡也可在豬的嘴部和馬的耳部出現。水泡內含有大量的病毒(平均為每毫升10-10感染單位),有病毒血症和全身感染,病理組織學變化可見淋巴管增生,感染4天后,大腦神經膠質細胞及大腦和心肌的單核細胞浸潤。本病容易康復,即使病情很重,7~10天也能痊癒。
在VSV屬中已知有Indiana、NJ、Alagoas、Piry和Chandipura 5個毒株可使人致病。人感染後20~30 h開始發作,可能開始於結膜,而後出現流感樣症狀:冷顫、噁心、嘔吐、肌痛、咽炎、結膜炎、淋巴結炎。小孩感染可導致腦炎。病程持續3~6天,無併發症及致死。
流行情況
早在1801年、1802年和1817年就有報導美國的馬、牛、豬感染本病。1862年美國內戰期間,因此病導致4 000匹戰馬不能作戰。以後美國幾乎每隔10年就暴發一次。後來墨西哥、中美洲、巴拿馬、委內瑞拉、哥倫比亞、秘魯、阿根廷、巴西、法國和南非等國相繼報導過本病。據OIE報導,南美、中美幾乎所有的國家和地區以及北美的美國等國家在1996—2002年暴發了大面積的VS流行,造成嚴重的經濟損失。?
VS常呈季節性暴發,易於晚夏零星的流行於熱帶潮濕地區。多在夏秋季(7~8月)發生,秋末趨於平息,霜凍後消失。但1982年在美國西部暴髮霜凍後仍在流行。VS的傳播多呈點狀散發,大多沿著河流、森林流行,結合其明顯的季節性,提示節肢動物可能在病毒的傳播中起到一定的作用。許多病例還表現為地方流行性及易感動物間的直接傳播。?
VS的流行區域中,由IND型引起的感染常見於野生樹棲和半樹棲動物,〖JP1〗而且已從白蛉、伊蚊和庫蚊中分離到了病原。引起動物發病中,NJ型是最主要的。通常產生多種臨床症狀,其潛伏期比IN型要短。?
NJ血清型和IND-1被認為是地方流行病,主要流行在美國東部、墨西哥、中美洲、巴拿馬、委內瑞拉、哥倫比亞、厄瓜多和秘魯。VSV基因複製的出錯傾嚮導致了病毒後代產生了許多變異株,然而在單個流行的地方株中,VSV的基因序列呈相對的穩定性,發生變異主要沿西半球的南北軸線展開。?
VS暴發的特點是常在2 h內突然暴發,侵犯一個牧場的大批畜群,在動物間流行時,接觸動物的人可被感染。?
診斷方法
VSV的診斷可採用的方法很多,病毒的分離培養、電鏡觀察、瓊脂免疫擴散、免疫電泳、酶聯免疫吸附試驗(ELISA)、補體結合(CF)試驗、中和試驗(VN)、聚合酶鏈式反應(PCR)等。OIE推薦IS-ELISA、CF等用於鑑定病毒抗原,LP?ELISA(液相阻斷ELISA)、VN、CF則用於血清學試驗。動物感染後4~5天即可產生特異性抗體。急性期和恢復期的血清中含有高效價的中和抗體和補體結合抗體,可用CF或SN來檢測抗體的增長情況。
5.1 病毒分離
一般水泡皮和水泡液中含有大量的病毒粒子,所以可用常用的方法分離到病毒。由於VSV的特殊形態,電鏡觀察可有效的鑑別病毒譜系。
可用Vero、BHK-21、IB-RS-2細胞作為水泡病的鑑別診斷。VSV 均能引起三者的病變效應(CPE);FMD能在BHK-21、IB-RS-2中產生CPE;SVD(豬水皰病)只能在IB-RS-2中產生CPE。?
5.2 ELISA
據有關報導,直接ELISA 、IS-ELISA(間接夾心ELISA),固相ELISA、LP-ELISA(液相阻斷ELISA)、Capture-ELISA等均可用於VSV檢測。?
ELISA普遍認為無型特異性,但Alonso.A.等用兔抗各型及亞型的多價血清包被酶標板,用以捕獲抗原;用豚鼠單價抗血清(針對某型或亞型的VSV)與抗原第二次結合,證明了ELISA能夠分型甚至亞型。相比瓊擴、補反、中和試驗,ELISA具有快速、可靠、靈敏度高的優點。血清學試驗中ELISA不能區別IN型與NJ型,可能由於二者存在共同的抗原所致,但ELISA可作為VSV與其他疫病的鑑別診斷的有效方法之一。?
ELISA以其高敏感性、不受前補體和抗補體因子的影響而被廣泛採用。若以病毒糖蛋白為抗原,因為他們無感染性,且檢測中和抗體的假陽性比VN試驗要低。?
5.3 補體(CF)試驗
用於早期抗體的定量。近年來廣泛採用微量補反試驗,一般幾小時內可完成。但它的敏感性低,常受補體和非特異因子的影響。?
CF檢測反芻動物血清時,加犢牛血清至補體中使其含量達5%,這種改良的CF一般的CF將更敏感。檢測馬血清無需犢牛血清。豬血清在滅活後通常仍會有前補體物質存在,從而限制了CF在其檢測中的套用,所以必須要有充足的正常豬血清對照以排除對CF試驗結果的干擾。?
5.4 中和試驗
可用動物或細胞中和試驗。動物中和試驗較少用,可用Vero細胞進行微量中和試驗。試驗要求活的病毒及細胞培養,要求嚴格的無菌環境,同時要3天后才出結果,比較麻煩,但結果比較準確。
5.5 PCR技術
是近年來發展起來的一種快速診斷技術,也是一種高敏感的實驗方法。此方法既無病毒複製過程,也無帶活毒的試驗,全部試驗可在1天內完成,能夠達到快速診斷的目的,同時也可檢出血樣中不具感染性的VSV,可用於持續性感染的檢測,快速鑑別診斷VSV、FMD、CV-B5病毒,同時還成功的區別VSV的兩種血清型。所以,PCR成為研究VSV的病原性及持續性感染的理想方法。
Hofner等建立的半巢式PCR技術,針對不同的血清型設計特異性的引物,可使印第安納型和新澤西型擴增出不同的產物,達到區別兩種血清型的目的。?
疫苗免疫及預防
自然康復的馬、牛至少有1年的免疫力。牛體內的中和抗體持續8年之久,但抗體的滴度在1月內可波動至1 000倍左右。
實驗證明針對G蛋白的抗體可中和病毒,通過抗體中和病毒和其他免疫學反應(如補體、巨噬細胞及T細胞、病毒感染細胞等)從而使實驗小鼠得到保護。
儘管在實驗小鼠中已有證明中和抗體能有效的阻止VSV的感染,中和抗體的出現卻不足以阻止牛在自然感染時的臨床症狀的表現。儘管有高的中和抗體,牛仍然可在早期30~60天再次感染同一株病毒,而後可達康復。許多表現為地方流行性VS症狀的動物,在疾病攻擊前體內早已有了中和抗體。?
顯然,在緊急情況下可用活的VSV野毒進行免疫。此方法曾被大量的套用於南美的牛群中,但會有散毒的危險。用甲醛、β-丙烯內酯或紫外線滅活的VSV可在小鼠體內產生弱的中和抗體。牛、鼠可用純化的VSV G蛋白的免疫來產生保護作用。 ?
目前DNA疫苗及基因重組苗的研製,為疫苗免疫開闢了新的途徑。Cantlon等人根據糖(G)蛋白能誘導機體產生中和抗體的原理,組建了一種新型DNA疫苗,用皮內注射的途徑刺激鼠、牛、馬可產生中和抗體,但分別產生了不同的免疫反應。若用表達白介素-2的基因重組疫苗或具有免疫刺激性的寡核苷酸鏈協同注射時可明顯提高抗體水平。?
目前美國已批准生產氫氧化鋁滅活苗。另一種油佐劑苗已在哥倫比亞做田間試驗。這兩種疫苗在接種馬和牛的血清中均能產生高水平的特異性抗體。但血液抗體能否保護該病尚不清楚。弱毒苗已在美國、巴拿馬、瓜地馬拉、秘魯和委內瑞拉做過田間試驗,結果均不可靠。目前,活苗(弱毒苗)或滅活苗都還未成為商品。?
由於VSV的廣泛流行性、高度感染性、變異性、抗體保護的特殊性,目前尚無一種安全有效的疫苗防制。一旦發生此病,應立即採取緊急隔離、封鎖、消毒等措施。同時在平時注意改善衛生環境,防止繼發感染是十分必要的。由於VSV的感染途徑比較複雜,有人建議從流行病學角度,建立一個防治昆蟲和寄生蟲的計畫作為防禦措施是完全合乎邏輯的。