基本性質
由於發生將離子轉變為新的離子物質或沉澱的水解反應,金屬陽離子的水化學相當複雜。當其溶解於純水溶液中時,陽離子M
z+被周圍的水分子
溶劑化。對於過渡金屬離子,在從水分子的充滿3d
1的成鍵軌道向過渡金屬的空d軌道會出現電荷轉移。這種相互作用造成氫上的部分正電荷增加,使得配位水分子酸性變得更強。根據電荷轉移的規模,建立如下的水解平衡:
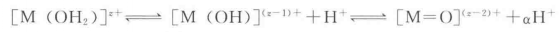 水和金屬離子的水解平衡
水和金屬離子的水解平衡上述平衡顯示了非絡合水介質中三種類型的配體:水合離子、羥基、和氧橋配體。水解度取決於幾個因素,包括電荷密度和金屬電負性,水合絡合物的配位數,反應溶液的PH。例如,在相似條件下,低價陽離子(z<4)傾向於生成水合水,羥基或水合羥基絡合物,而高價陽離子(z>5)形成氧橋或氧橋羥基絡合物。取決於溶液的pH,四價金屬能形成任何可能的絡合物。
反應機制
這些溶劑化金屬離子的縮合可繼續通過兩種可能的機制進行反應。
1、羥橋反應是在兩個金屬中間形成的一個或更多的羥基橋的過程。對於飽和配位的羥基水合前驅體,羥橋反應通過親核取代機制發生,這裡羥基基團是親核試劑,水是脫離基團。氧橋反應是在兩個金屬離子間形成氧橋的過程,其中金屬配位不飽和,氧橋反應通過導致邊緣或表面共享的多面體的親核加成快速發生。對於配位飽合的金屬,氧橋過程通過氧羥基前驅體間兩步取代反應進行,包含了親核加成及隨後通過消除水形成M-O-M鍵的過程。
2、帶電的前驅體,不能無限制地縮合形成金屬氧化物的固體相。在取代反應過程中,由於提供電子
的水分子從金屬中心被消除,使得羥基配體
親核性降低並使縮合反應終止。取決於金屬的特性和反應條件,縮合反應通常限制了二聚體和四聚體的形成。為了獲得縮合產物(即溶膠和凝膠),需要改變反應條件,例如改變溫度或溶液PH。這些變數通過控制從溶膠態到凝膠態轉變的整個過程中金屬氧化物物種的生長與凝聚。
水解常數計算
實際分析29種金屬離子的實測水解常數的負對數 pKm 與離子半徑 r、電荷 Z 、電子層數 M、離子勢Z2/r的關係,的確是線性相關的。若金屬離子的半徑小,電荷高,離子勢大,則它的σ雜化軌道接受氧的非鍵電子對的能力強形成 M→OH配鍵的鍵能大,O—H鍵就弱 ,失去H+的能力強,金屬離子水解程度大,pKm小。
反之亦反,經擬合得到經驗公式:pKm=19.04r-3. 65Z+3. 56M - 0.74( Z2/r) + 1.16。
影響因素
1、金屬離子與配位水分子中氫之間的排斥作用;
2、金屬離子與配位水分子中氧之間的相互作用 導致氫氧鍵斷裂;
3、溶劑水分子對水合金屬離子的影響。
金屬離子水解能力的大小與離子所帶電荷、離子半徑和最外電子層結構有密切關係。水解常數愈大,水解平衡反應向右進行的傾向愈大。ⅠA、ⅡA族具有惰氣構型的陽離子(Be2+、Al3+等半徑較小的離子除外)的水解能力都較小。他們的水解能力隨著離子電荷的平方與離子半徑的比值的增大而增大。Be2+、Mg2+、Al3+、Sc3+因離子半徑很小,電荷高,離子周圍的電場強度相當大,能促使水分子變形,乃至鍵斷裂釋放出氫離子。因為過渡金屬具有非惰氣構型的電子層結構,水解常數都較大,水解的結果是水溶液中H+濃度增大。從鹼的電離情況可以知道,NaOH、KOH、Ca(OH)2、Sr(OH)2等強鹼中的陽離子在水中幾乎不發生水解。
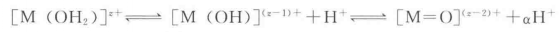 水和金屬離子的水解平衡
水和金屬離子的水解平衡