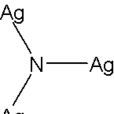
基本介紹
- 中文名:氮化銀
- 外文名:Silver nitride
- 又稱:雷爆銀
- 化學式:Ag3N
- 溶解性:略溶於水
- 危險性:易爆炸,溶液呈強鹼性
- 外形:黑色固體
理化性質,化學反應,其他,相關擴展,
理化性質
Ag3N為分子晶體。大於120攝氏度時爆炸分解。
黑色固體,能略溶於水、能溶於吡咯烷,溶液無色,顯強鹼性:
Ag3N + H2O ——→ OH- + (HAg3N)+
Ag3N + HN(CH2CH2)2——→(N(CH2CH2)2)- + (HAg3N)+(Ag3N為強路易斯鹼)
具有氧化性,其溶液和其他金屬單質反應生成氫氧化物或羥基絡合物,同時生成Ag單質。
化學反應
3Ag2O+2NH3→2Ag3N+3H2O
氧化銀可以溶解在過量的氨水(1molAg∶4mol以上NH3)中生成氫氧化銀氨溶液:
3Ag2O+12NH3+3H2O→6Ag(NH3)2OH
該溶液沒有危險性。
如果銀氨溶液因蒸發或加入強鹼而失去氨,那么就會有氮化銀從溶液中沉澱出來。這些具有爆炸性的沉澱呈黑色粒狀或硬殼狀,或沉積在容器壁上呈鏡狀。制銀鏡的溶液和杜倫試劑都特別容易產生Ag3N。把強鹼加到含氨的氯化銀(AgCl)溶液中也會產生Ag3N,也許其它的含氨銀溶液亦如此。新鮮的Ag3N沉澱易溶於過量的氨水中,陳舊的氮化銀沉澱則含有不定量的不溶於氨水的金屬銀。
乾燥的氮化銀是能夠存在的最敏感的化合物之一、即使是非常輕微的觸摸,甚至落下的一滴水所產生的衝擊也能使它爆炸。它的爆炸力與它按下式分解時能夠釋放出能量有關。
2Ag3N→6Ag+N2
氮化銀在貯藏時也按上式緩慢地分解,因此,不受干擾的氮化銀沉澱不會自行爆炸,放置足夠長的一段時間以後,其爆炸性將盡失。
可以預料,銷毀氮化銀沉澱最好是在原容器中加入稀氨水(2mol·L-1)或碳酸銨濃溶液,這兩種溶液都能溶解氮化銀並使之轉變為無爆炸性的銀氨溶液。為了慎重起見,加這兩種溶液時應盡最靠近沉澱物,同時還應穿戴好護眼和防濺用具,因為任何擾動都有可能引起氮化銀爆炸。潮濕的氮化銀很難傳爆,因此,用這兩種水溶液處理氮化銀沉澱可以使潛在的危險性有所減少。
其他
一般來說,用過量的氨水製備銀氨溶液、防止所得溶液失去氨、及時處理用過的的和剩餘的銀試劑,基本上可以避免生成危險的Ag3N。回收多餘銀試劑中的銀,一個既安全又簡單易行的方法是先在銀試劑中加入氯化鈉(NaCl)濃溶液、然後再作進一步的處理。
相關擴展
氮化銀(Ag3N)和疊氮化銀(AgN3)
氮化銀由銀蒸氣同氨在1550K反應製得;用結晶法從氧化銀的氨溶液中也可以製得純的Ag3N,它不溶於冷水,但能被硝酸分解成為硝酸銀和硝酸銨,鹽酸和硫酸也能發生類似反應。加入氰化鉀溶液時,則分解且釋出氨。
Ag3N+6CN-+3H2O—→3(Ag(CN)2)- +3OH-+NH3
Ag3N+6CN-+3H2O—→3(Ag(CN)2)- +3OH-+NH3
氮化銀比疊氮化銀更容易猛烈爆炸,當溫度高於140℃時,它會自發進行爆炸,並對震動或摩擦非常敏感,甚至在水中它對撞擊也是靈敏的。
疊氮化銀是白色沉澱,它由疊氮酸HN3,與硝酸銀溶液反直製得,反應非常靈敏,可以用來檢驗溶液中少於百萬分之一的HN3,另外聯胺亦可從硝酸銀溶液中沉澱出AgN3,疊氮化銀溶於稀硝酸,但不溶於鹼溶液和氮化銀一樣,它是一個很強烈的爆炸物質。當溫度高於250 ℃時,它分解放出氮,在300℃時,就發生劇烈爆炸。它感光分解為單質的作用較靈敏(比鹵化銀差),易被照相顯影劑還原。它與溴反應迅速,生成溴化銀和氮。 2AgN3+Br2—→2AgBr+3N2