利用Tollens試劑鑑別醛酮的反應。Tollens試劑即硝酸銀的氨水溶液。一種弱氧化劑。可將醛氧化為羧酸,並產生金屬銀沉積於玻璃反應器皿壁上(銀鏡)。用於鑑別醛,而酮則不反應。該試劑應現配現用,不宜保存,久置易生成易爆的雷酸銀和氮化銀。
基本介紹
- 中文名:Tollens反應
- 重要底物:Tollens試劑
- 作用:鑑別醛酮
- 學科:有機化學
Tollens試劑
配製方法
銀鏡反應
注意事項
果糖的Tollens試劑反應
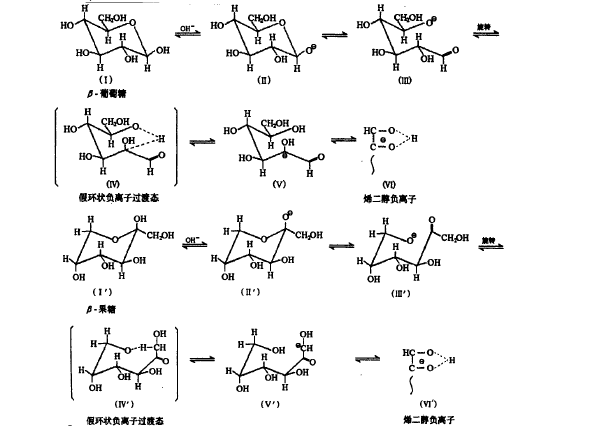 烯醇化歷程
烯醇化歷程
利用Tollens試劑鑑別醛酮的反應。Tollens試劑即硝酸銀的氨水溶液。一種弱氧化劑。可將醛氧化為羧酸,並產生金屬銀沉積於玻璃反應器皿壁上(銀鏡)。用於鑑別醛,而酮則不反應。該試劑應現配現用,不宜保存,久置易生成易爆的雷酸銀和氮化銀。
 烯醇化歷程
烯醇化歷程利用Tollens試劑鑑別醛酮的反應。Tollens試劑即硝酸銀的氨水溶液。一種弱氧化劑。可將醛氧化為羧酸,並產生金屬銀沉積於玻璃反應器皿壁上(銀鏡)。用於鑑別醛,而酮...
之後,Tollens、L. Henry、Duden、Franchimont等人發現了其他類型的曼尼希反應,包括以硝基烷和伯硝胺作酸組分的反應,但都沒有意識到這些反應所具有的普遍意義。1912...
Stobbe縮合反應66Tollens反應68van Leusen還原氰基化反應68Wittig反應69Wittig-Horner反應711.3金屬和元素有機化合物介導的碳碳鍵形成反應73...
16 46Tollens反應59016 47Wittig反應59116 48Tebbe,Petasis和交替的烯基化59416 49Thorpe反應59416 2 1 10其它碳親核試劑59416 50矽烷的加成594...
又叫吐倫試劑[1] 。化學式: Ag(NH3)2OH 性質:可將醛氧化為羧酸,並產生金屬銀沉積於玻璃反應器皿壁上(銀鏡),常用於製作瓶膽和鑑別還原糖。用於鑑別醛基,而...
4 1 45Stetter反應(Michael Stetter反應)1614 1 46Stobbe縮合反應1624 1 47Stork烯胺反應1624 1 48Tollens反應1644 1 49Vilsmeier Haack反應164...
還有一種氧化反應基於銀鏡反應,該反應中,醛與Tollens試劑混合(其製備方法為:滴加氫氧化鈉溶液至硝酸銀溶液中,得到析出的氧化銀,而後滴加足量的氨水溶液以溶解析出...
