化學性質
具有兩性但其鹼性強於酸性,新製得的氫氧化鐵(水合氧化鐵)
易溶於
無機酸和
有機酸,亦可溶於熱濃鹼。具有強氧化劑(如
次氯酸鈉)在鹼性介質中,能將新制的氫
氧化鐵(水合氧化鐵)氧化成+6
氧化態的
高鐵酸鈉(Na
2FeO
4)。加熱時逐漸分解而成氧化鐵和水。不溶於
水、
乙醚和乙醇,溶於酸,在酸中的溶解度隨製成時間的長短而定,新制的易溶於酸,若放置時間長,則難溶解。氫氧化鐵可用來制顏料、藥物,也可用來做
砷的解毒藥等等。
低於500攝氏度時完全脫水成氧化鐵。加熱分解。氫氧化鐵在烘乾時易分解,但溫度不高時不完全,也就是逐漸失水。但在低於500℃時能達到完全脫水成氧化鐵。沒有一個明確的失水
分解溫度。
由可溶性鐵酸鹽和
二氧化碳反應沉澱來製取氫氧化鐵。其粒子大小在1 nm到100 nm之間時會形成
膠體。膠狀沉澱的水合氧化鐵有較強的吸附性能。
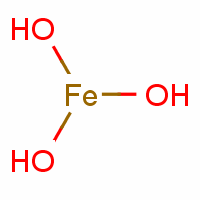
氫氧化鐵是鐵的氫氧化物,由
鐵酸鹽([Fe(OH)
6]
3-)和
二氧化碳(CO
2)生成:
2[Fe(OH)6]3-+3CO2====2Fe(OH)3(s)+3CO32-+3H2O
(註:可溶性鐵鹽溶液與
4Fe(OH)2+O2+2H2O====4Fe(OH)3
Fe(OH)
3它是一種紅褐色沉澱,是鐵的最穩定氧化物-氫氧化物的水合物。加熱分解成氧化鐵和水:2Fe(OH)
3==△==Fe
2O
3+ 3H
2O。氨水或鹼溶液作用於
鐵鹽溶液所得到的紅棕色或黃棕色沉澱,經X射線晶體學研究是
非晶態的,它含有可變數的水。一般認為該沉澱含有
氫氧化氧鐵FeO(OH),至少有兩種結晶變體:α-FeO(OH)(
針鐵礦)和γ-FeO(OH)(纖鐵礦),鐵的正常生鏽產生的是γ-變體。
氫氧化鐵的兩性電離:
酸性:

Fe(OH)3+6H2O====[Fe(H2O)2(OH)4]-+H+(可逆反應)
[Fe(H2O)2(OH)4]-====[Fe(H2O)(OH)5]2-+H+(可逆反應)
[Fe(H2O)(OH)5]2-====[Fe(OH)6]3-+H+-(可逆反應)
鹼性:
Fe(OH)3+6H2O=[Fe(H2O)6]3++3OH-(可逆反應)
所以,氫氧化鐵既是一種
三元弱鹼,又是一種三元弱酸。
化學方程式
2Na3[Fe(OH)6]+3CO2====2Fe(OH)3(s)+3Na2CO3+3H2O
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
受熱分解產物及方程式:
2Fe(OH)3 ==△== Fe2O3 + 3H2O
Fe(OH)3 + 3OH-= [Fe(OH)6]3-
製備方法
膠體
(1)取一個小燒杯,加入25 mL蒸餾水,將燒杯中的蒸餾水加熱至沸騰。
 氫氧化鐵的丁達爾效應
氫氧化鐵的丁達爾效應(2)向沸水中逐滴加入5 ~ 6滴飽和氯化鐵溶液。
(3)繼續煮沸至溶液呈紅褐色,停止加熱。
此時即可製得
氫氧化鐵膠體,用雷射筆照射燒杯中的液體,在垂直於光線的方向可以看到一條光亮的“通路”,即
丁達爾效應。
固體沉澱
在試管里注入少量
鐵酸鈉溶液,再通入
二氧化碳,生成
氫氧化鐵:2Na
3[Fe(OH)
6]+3CO
2====2Fe(OH)
3(s)+3Na
2CO
3+3H
2O
套用領域
用於製造醫藥、顏料,並用作砷解毒劑等。其膠體可用於淨水。

 氫氧化鐵的丁達爾效應
氫氧化鐵的丁達爾效應
