常見離子
有色離子(Colored ion)
在水溶液中,有些離子是有色的。
常見的有色離子有:
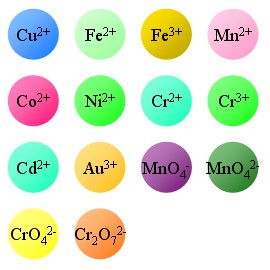 有色離子的顏色
有色離子的顏色Cu2+ 銅離子-----------藍色
Fe2+ 亞鐵離子-----------淺綠色
Fe3+ 鐵離子 -----------淡紫色(溶液中一般呈現棕黃色)
Mn2+ 錳離子-----------淺粉色
Co2+ 鈷離子-----------粉色
Ni2+鎳離子---------綠色
Cr2+亞鉻離子 -----------藍綠色
Cr3+鉻離子 -----------綠色
Cd2+ 鎘離子 -----------藍綠色
Au3+ 金離子--------金黃色
MnO4- 高錳酸根離子 ----------紫紅色
MnO42- 錳酸根離子 ---------墨綠色
CrO42-鉻酸根離子 ---------黃色
Cr2O72-重鉻酸根離子 --------橙色
[Fe(SCN)]2+ 硫氰合鐵絡離子------血紅色
[CuCl4]2- 四氯合銅絡離子--------黃色
Fe3+遇到SCN-時的顏色--------血紅色
有色物質
1. 有色氣體:Cl2(黃綠色)、NO2、Br2(氣)紅棕色
2. 液體:Br2(紅棕色)
3. 有色固體:紅色Cu、Cu2O、Fe2O3
紅褐色:Fe(OH)3
綠色:Cu2(OH)2CO3,FeSO4*7H2O
藍色:Cu(OH)2,CuSO4*5H2O
黑色:CuO,FeS,CuS,MnO2,C,FeO,Ag2S
淺黃色:S,AgBr
黃色:AgI,Ag3PO4
4. 有色溶液:Cu2+(藍色)、Fe2+(淺綠色)、Fe3+(黃色)、MnO4-(紫紅色)、溴水(橙色)。
5. 焰色反應:Na+(黃色)、K+(紫色)
6. 使品紅褪色的氣體:SO2(加熱後又恢復到紅色)、Cl2(加熱後不恢復紅色)
顏色變化的反應:
1.蛋白質遇
硝酸變黃(如做實驗時,被某液體濺到皮膚上,皮膚變黃)
2.酚類遇Fe3+顯紫色
3.Fe
3+遇SCN-呈現血紅色
4.Fe2+(淺綠色或灰綠色)遇比較強的氧化劑變成Fe3+(黃色)
5.Fe(OH)2(白色),在空氣或溶液中會迅速變為灰綠色沉澱,最後變為Fe(OH)3紅褐色沉澱.
7.澱粉遇碘變藍
8.氧化漂白:
次氯酸HClO(氯氣通到濕潤的有色布條,使有色布條褪色,其實是氯氣與水生成 次氯酸HClO,而次氯酸HClO具有強氧化性使布條褪色),臭氧O
3,雙氧水H
2O
2等都可使高錳酸鉀溶液褪色
9.二氧化硫通入品紅溶液,品紅溶液褪色,但非氧化漂白,再加熱品紅溶液,顏色恢復.
10.不飽和烴(如烯烴,炔烴等)會使溴水或高錳酸鉀溶液褪色(與溴發生加成反應,還原高錳酸鉀)
11.苯酚(固體)在空氣中露置被氧氣氧化變為粉紅色
12.2NO(無色)+O2=2NO2(紅棕色)
13. NO2(紅棕色)=N2O4(無色) (由於技術有限,這裡的等號應為可逆號)(正反應條件是加壓,逆反應條件反之)
14.黑色氧化銅CuO會與還原性物質(如氫氣H2,一氧化碳CO,碳C等)反應生成紅色的銅Cu。
15.醛基與銀氨溶液反應生成光亮的銀鏡 (反應要在水浴中進行)
16.醛基與新制氫氧化銅懸濁液反應,反應現象是藍色絮狀沉澱(Cu(OH)2)到磚紅色沉澱(Cu2O)
17.無機反應(沉澱或有色離子) CH3COO-與 Pb2+ Ba2+與SO42-Ba2+與SO32-Sn2+與SO42- Ag+與Cl- Hg+(Hg2Cl2) 與Cl- 等等都是生成白色沉澱
18. Cu2+與鹼生成Cu(OH)2藍色沉澱.
19.Fe2+與鹼生成Fe(OH)2,但它易被氧化,所以實驗現象中沒有我們期望的白色沉澱,而是灰綠色沉澱,過一段時間最終形成Fe(OH)3紅褐色沉澱.
20.Fe3+與鹼生成Fe(OH)3紅褐色絮狀沉澱
21.溴蒸汽呈紅棕色
22.液溴呈深紅色
23.溴的四氯化碳呈橙紅色
24.碘單質呈紫黑色
25.碘蒸氣呈紫紅色
26.碘的四氯化碳呈紫紅色
27.氯氣呈黃綠色
28.氟氣呈淡黃色
亞鐵離子
物質特性
在化學上面叫亞的物質的化學價一定比其的最高的化學價低 但是不一定是處於中間的化學價(如氯的化學價就有-1 0 +1 +3 +5 +7化學價 +7價為它的最高的化學價 只有+3才被稱為亞)
注意:亞鐵鹽水溶液大多為淺綠色,但是氫氧化亞鐵[Fe(OH)2]為難溶於水的白色固體。
成熟濾層的接觸氧化除鐵速率
水中的亞鐵離子在成熟濾層中被去除,經歷以下諸步驟:亞鐵離子由水中向濾料表面擴散;亞鐵離子被濾料表面的活性濾膜吸附;被吸附的亞鐵離子水解並被氧化,生成高鐵氫氧化物——鐵質活性濾膜。上述諸步驟中,反應速度最慢者將成為除鐵速率的控制步驟。實驗表明,亞鐵離子向濾料表面擴散可能是除鐵速率的控制因素。實驗還表明,濾料上活性濾膜只以外表面吸附水中的亞鐵離子。
根據菲克定律,亞鐵離子向濾膜表面擴散時,擴散速率與水中和濾膜表面的亞鐵離子濃度差(C-C’)成正比,與濾膜表面的邊界層厚度σ成反比。如果將擴散速率作為除鐵速率,並認為C’很小可忽略不計,則
-dc/dt=DS/D(C-C’)≈DS/σ·C (1)
式中 t——時間,t=ml/u;
l——濾層的厚度;
m——濾層孔隙度;
u——濾速;
D——擴散係數;
S——單位體積濾層中濾膜的外表面積,S=6a(1-m)/d;
d——濾料粒徑;
a——濾料的形狀係數;
σ——邊界層厚度;
C’——濾膜表面上的亞鐵離子濃度。
將上列各參數代入式(1)得
-dc/dι=βC (2)
β=6Dam(1-m)/ σdu (3)
式中β稱為濾層的接觸催化活性係數。
當水在濾層中呈層流狀態流動時,可以認為邊界層厚度為一定值(σ=const)。
Fe(OH)2沉澱時的pH:Fe2+從開始沉澱到沉澱完全時溶液的pH(常溫下):7.6~9.6。
Fe(OH)2氧化為為Fe(OH)3的顏色變化:Fe(OH)2沉澱氧化為為Fe(OH)3時顏色變化為白色到灰綠色再到紅褐色。
Fe(OH)2實驗:
在實驗室中如果想製取Fe(OH)2,可以以FeCl2和NaOH為原料。先煮沸FeCl2和NaOH溶液,再用長滴管吸入NaOH溶液並將其伸入FeCl2溶液液面以下,就可製得Fe(OH)2。
 有色離子的顏色
有色離子的顏色


 有色離子的顏色
有色離子的顏色

