基本介紹
- 中文名:曼尼希反應(
- 外文名:Mannich反應
- 別稱:曼氏反應
- 套用學科:有機化學
- 適用領域範圍:化工生產
- 反應機理:胺對羰基發生親核加成
- :
概述
反應機理
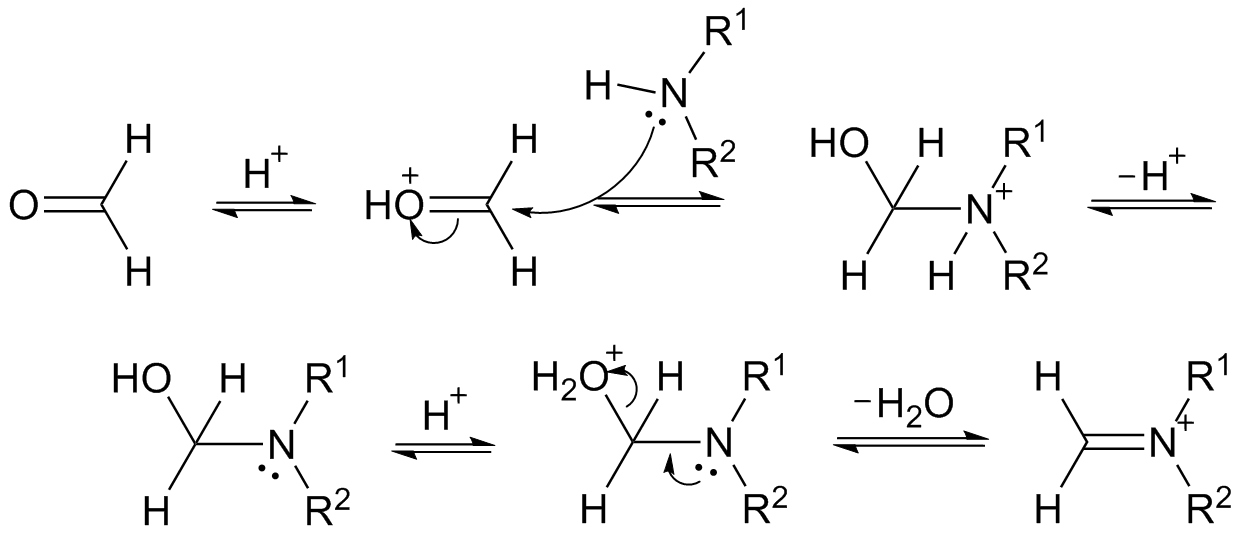 反應機理
反應機理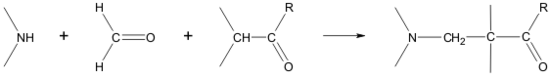
 反應機理
反應機理
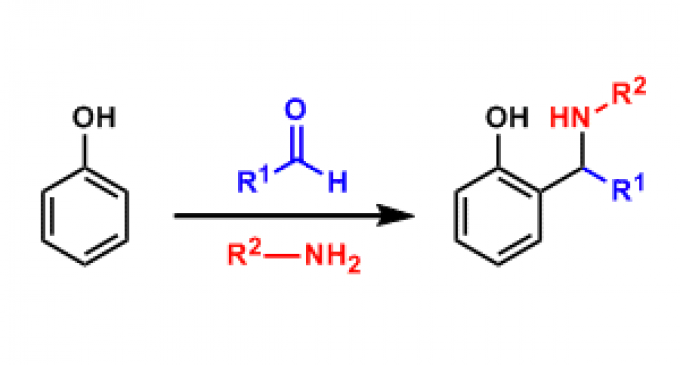
曼尼希反應(Mannich反應,簡稱曼氏反應),也稱作胺甲基化反應,是含有活潑氫的化合物(通常為羰基化合物)與甲醛和二級胺或氨縮合,生成β-氨基(羰基)化合物的有機化學...
曼尼希反應(Mannich Reaction) 醛、酮等具有活潑α-H的化合物(酸、酯、硝基化合物、氰基化合物、末端炔烴…)與甲醛、胺(一級胺、二級胺或氨)在乙醇溶液中回流...
縮合反應是兩個或兩個以上有機分子相互作用後以共價鍵結合成一個大分子,並常...曼尼希反應 維蒂希(wittig)反應醛或酮與維蒂希試劑發生縮合,是合成烯烴的重要方法...
與之反應的親電試劑通常是醛或酮(這裡有許多變化如曼尼希反應)。若親核試劑和親電試劑不同,反應稱作:交叉羥醛反應;若親核試劑和親電試劑相同則稱作:羥醛二聚化...
與胺、甲醛和一個羰基化合物發生曼尼希反應。與烯醇發生羥醛縮合或者Baylis-Hillman反應。與有機金屬親核試劑發生格氏反應、Reformatsky反應或者Barbier反應。...
曼尼希反應(Mannich反應):也稱作胺甲基化反應,是含有活潑氫的化合物(通常為羰基化合物)與甲醛和二級胺或氨縮合,生成β-氨基(羰基)化合物的有機化學反應。一般醛...
芳醛與含α-H的脂肪族酸酐,在相應的羧酸鹽存在下共熱,發生縮合生成α,β-不飽和酸,該反應稱為珀金(Perkin)反應。(2)Mannich反應...
在科學方面,闡明了以硝仿為酸組份的曼尼希反應機理,發現了三硝基乙基-N-亞硝基化反應,合成了近20種文獻未報導的新化合物,研究了炸藥的能量判據以 及炸藥的熱...
存分子寸,引人氨(膠)烷獲(FI,VR或IbNR一)的反應過程。_烴基銅銼1與丙烯睛2加成,生成3,還原成為氦丙基化合物40曼尼希反應則是氨甲基化的重要方法 ...
3位上還可發生多種反應,如形成格氏試劑,與醛縮合,以及發生曼尼希反應等。中文名 吲哚 英文名 Indole 別稱 氮雜茚;苯並吡咯等 化學式 C8H7N 分子量 117...
曼尼希反應(Mannich反應,簡稱曼氏反應),也稱作胺甲基化反應,是含有活潑氫的化合物(通常為羰基化合物)與甲醛和二級胺或氨縮合,生成β-氨基(羰基)化合物的有機化學...
Mori-Ban吲哚合成反應,含有烯丙胺結構的鄰鹵代苯胺發生分子的Heck反應製備吲哚的...3位上還可發生多種反應,如形成格氏試劑,與醛縮合,以及發生曼尼希反應等。 [3...
胺的極性轉換:胺的極性轉換可通過形成亞胺離子(曼尼希反應)或形成亞硝胺來完成。 [1] 參考資料 1. 呂萍,王彥廣.經典有機反應中的極性反轉[J].大學化學,2016,...
3位上還可發生多種反應,如形成格氏試劑,與醛縮合,以及發生曼尼希反應等。 [1] 參考資料 1. Gribble G W,Hoffman J H ,synthesis,1977:859 ...
胺的極性轉換:胺的極性轉換可通過形成亞胺離子(曼尼希反應)或形成亞硝胺來完成。V百科往期回顧 詞條統計 瀏覽次數:次 編輯次數:7次歷史版本 最近更新: Fenchyl...
芳醛與含α-H的脂肪族酸酐,在相應的羧酸鹽存在下共熱,發生縮合生成α,β-不飽和酸,該反應稱為珀金(Perkin)反應。(2)Mannich反應...
本書較系統地介紹了有機合成原理、反應、設計及現代技術,全書共分13章,包括...3.1.1 Friedel-Crafts反應3.1.2 醛或酮及其衍生物的反應3.1.3 曼尼希反應...
2.甲基唆哩琳的甲基尚可與草酸乙醋發生克萊遜縮合反應(Claisen condensation),而4一甲基唆哩琳則與胺及甲醛發生曼尼希反應} Nlanich reaction)。...
第三節 酯縮合反應一、酯-酯縮合二、酯-酮縮合三、酯-腈縮合第四節 其他縮合一、曼尼希反應二、達參反應三、克腦文革縮合四、柏琴反應...
CH:一義Me=l將二甲胺與二碘甲烷反應,生成的季鉸鹽Me3}l OHzI·I十15U℃在環j_礬中加熱製取。在曼尼希反應中用作氨甲基化試劑。[1] ...
為迄今發現的強心糖昔配基中含氧量h}多的一種。由毒毛旋花萃取而得的烏巴(箭毒)營經曼尼希反應水解製取。有強』L.}作用二[1] ...
法尼基丙酮製備屬於經典的不飽和酮,不飽和雨合成常用的方法有很多,carroll重排,曼尼希反應反應都可用來合成不飽和酮。 [1] Carroll 重排反應機理 編輯 反應機理 ...
3位上還可發生多種反應,如形成格氏試劑,與醛縮合,以及發生曼尼希反應等。 吲哚 參考資料 1. 3-吲哚乙腈 圖集 3-吲哚乙腈圖冊 V百科往期回顧 詞條統計 瀏覽...
第三節 酯縮合反應一、酯-酯縮合二、酯-酮縮合三、酯-腈縮合第四節 其他縮合一、曼尼希反應二、達參反應三、克腦文革縮合四、柏琴反應...
