炔烴簡介 炔烴 (拼音:quētīng;英文:Alkyne)是一類
有機化合物 ,屬於
不飽和烴 。其官能團為碳-碳三鍵(-C≡C-)。通式
Cn H2n-2 ,其中n為>=2正整數。簡單的炔烴化合物有
乙炔 (C
2 H
2 ),
丙炔 (C
3 H
4 )等。炔烴原來也被叫做
電石 氣,電石氣通常也被用來特指炔烴中最簡單的乙炔。
“炔”字是新造字,音同缺(quē),左邊的火取自“碳”字,表示可以燃燒;右邊的夬取自“缺”字,表示氫原子數和化合價比
烯烴 更加缺少,意味著炔是
烷 (完整)和
烯 (稀少)的不飽和
衍生物 。
炔烴的結構 炔烴的
碳原子 2S軌道同一個2P軌道
雜化 ,形成兩個相同的SP
雜化軌道 。堆成地分布在碳原子兩側,二者之間夾角為180度。
乙炔碳原子一個SP雜化軌道同氫原子的1S軌道形成碳氫
σ鍵 ,另一個SP雜化軌道與相連的碳原子的SP雜化軌道形成碳碳σ鍵,組成直線結構的乙炔分子。未雜化的兩個P軌道與另一個碳的兩個P軌道相互平行,“肩並肩”地重疊,形成兩個相互垂直的
π鍵 。
結構測定 乙烯分子中鍵長 乙炔分子中鍵長 上列圖片顯示,由於
π鍵 的出現,使碳碳間的距離縮短,而且三鍵比雙鍵更短。這是因為隨著
不飽和度 的增大,兩個碳原子之間的
電子云 密度也增大,所以
碳原子 越來越靠近。上列數字還表明:碳氫化合物中的碳氫鍵的鍵長也不是一個常數。這說明:鍵長除了與成鍵原子的不飽和度有關外,還和參與成鍵的碳原子的雜化方式有關。即隨著雜化軌道中s成分的增大,碳碳鍵的鍵長縮短。
乙烷 、
乙烯 和
乙炔 中的碳原子的s成分分別為25%,33%和50%,從sp3到sp,碳原子的s成分增大了一倍,所以碳碳鍵的鍵長越來越短。
由於雜化碳原子的s成分不同,
丙烷 、
丙烯 、
丙炔 中的碳碳單鍵的鍵長是不等長的,s成分越多,碳碳單鍵的鍵長越短,隨著鍵長的縮短,原子間的鍵能將增大。
物理性質 炔烴 的熔沸點低、密度小、難溶於水、易溶於
有機溶劑 ,一般也隨著分子中碳原子數的增加而發生遞變。炔烴在水中的溶解度比
烷烴 、烯烴稍大。
乙炔 、
丙炔 、1-丁炔屬弱極性,微溶於水,易溶於非極性溶液中碳架相同的炔烴,三鍵在鏈端極性較低。炔烴具有偶極矩,烷基支鏈多的炔烴較穩定。
相對蒸氣密度:(空氣=1):0.91。
蒸氣壓(kPa):4053(16.8℃)。閃點<-50℃。
燃燒熱:1298.4kJ/mol
鍵能:837kJ/mol
穩定性和反應活性: 不穩定、非常活躍 。
避免接觸的條件:受熱。
危險特性:極易燃燒爆炸。與空氣混合能形成爆炸性混合物,遇明火、高熱能引起燃燒爆炸。與氧化劑接觸猛烈反應。與
氟 、
氯 等接觸會發生劇烈的
化學反應 。能與銅、銀、汞等的化合物生成爆炸性物質。
簡單炔烴的沸點、熔點以及密度,一般比碳原子數相同的烷烴和
烯烴 要高一些。這是由於炔烴分子較短小、細長,在液態和固態中,分子可以彼此很靠近,分子間的
范德華力 (van der Waals作用力)很強。炔烴分子略
極性 比烯烴強。烯烴不易溶於水,而易溶於
石油醚 、
乙醚 、
苯 和
四氯化碳 中。一些炔烴的名稱及
物理性質 列入下表:
一些常見炔烴的名稱及物理性質 化合物 熔點/℃ 沸點/℃ 相對密度 乙炔
-82(在壓力下)
-82(升華)
—
丙炔
-102.5
-23
—
1-丁炔
-122
8
—
1-戊炔
-98
40
0.695
1-己炔
-124
71
0.719
1-庚炔
-80
100
0.733
1-辛炔
-70
126
0.747
2-丁炔
-24
27
0.694
2-戊炔
-101
56
0.714
2-己炔
-88
84
0.730
3-己炔
-105
81
0.725
化學性質 加成反應 親電加成
乙炔及其取代物與烯烴相似,也可以發生
親電加成 反應,但由於sp碳原子的電負性比sp2碳原子的電負性強,使電子與sp碳原子結合得更為緊密,儘管三鍵比雙鍵多一對電子,也不容易給出電子與親電試劑結合,因而使三鍵的親電加成反應比雙鍵的親電加成反應慢。
乙炔及其衍生物可以和兩分子親電試劑反應。先是與一分子試劑反應,生成烯烴的
衍生物 ,然後再與另一分子試劑反應,生成飽和的化合物。不對稱試劑和炔烴加成時,也遵循馬氏規則,多數加成是反式加成。
與鹵素的加成
鹵素和炔烴的加成為反式加成。反應機理與鹵素和
烯烴 的加成相似,但反應一般較烯烴難。例如,烯烴可使溴的四氯化碳溶液立刻褪色,炔烴卻需要幾分鐘才能使之褪色。故分子中同時存在非共軛的雙鍵和叄鍵,在它與溴反應時,首先進行的是雙鍵的加成。
又如,乙炔與氯的加成反應須在光或三氯化鐵或氯化亞錫的催化作用下進行,中間產物為反二氯乙烯,最後產物為
1,1,2,2-四氯乙烷 (CHCl
2 CHCl
2 )。
與氫鹵酸的加成
炔烴和氫鹵酸的加成反應是分兩步進行的,選擇合適的反應條件,反應可控制在第一步。這也是制鹵化烯的一種方法。
當炔鍵兩側都有取代基時,需要比較兩者的
共軛效應 和
誘導效應 ,來決定反應的區域選擇性,但一般得到的是兩種異構體的混合物。
與水加成
炔烴和水的加成常用汞鹽作催化劑。例如,乙炔和水的加成是在10%硫酸和5%
硫酸亞汞 水溶液中發生的。
水先與三鍵加成,生成一個很不穩定的加成物——乙烯醇[羥基直接和雙鍵碳原子相連的化合物稱為烯醇]。乙烯醇很快發生異構化,形成穩定的羰基化合物。
炔烴與水的加成遵循
馬氏規則 ,因此除乙炔外,所有的取代乙炔和水的加成物都是酮,但一元取代乙炔與水的加成物為甲基酮,二元取代乙炔的加水產物通常是兩種酮的混合物。
自由基加成
與氫氰酸加成
反應中CN-受限於三鍵進行親核加成形成碳負離子,再與質子作用,完成生成丙烯腈的反應。上法因乙炔成本較高,現世界上幾乎都採用丙烯的氨氧化反應制丙烯腈,反應過程是丙烯與氨的混合物在400~500℃,在催化的作用下用空氣氧化。
聚丙烯腈 可用於合成纖維(
腈綸 )、塑膠、
丁腈橡膠 。此外,丙烯腈電解加氫二聚,是一個新的成功合成己二腈的方法。
己二腈 加氫得己二胺,己二腈水解得己二酸,是製造
尼龍 -66的原料。
與氫加成
乙炔或其一元取代物可與帶有下列“活潑氫”的有機物,如—OH,—SH,—NH2 ,=NH,—CONH2 或—COOH發生加成反應,生成含有雙鍵的產物。例如,乙醇在鹼催化下於150~180℃,0.1~1.5MPa下與乙炔反應,生成乙烯基乙醚。
根據原料的不同,反應條件(即溫度、壓力i、催化劑等)也可以不同。這類反應的反應機理是烷氧負離子與三鍵進行親核加成,產生一個碳負離子中間體,碳負離子中間體從醇分子中得到質子,得
產物 。
還原 催化加氫:在常用催化劑鈀、鉑或鎳的作用下,炔烴與2 mol H
2 加成,生成
烷烴 。中間產物難以分離得到。
若用Lindlar(林德拉)催化劑(
鈀 附著於
碳酸鈣 及小量
氧化鉛 上,使催化劑活性降低)進行炔烴的催化氫化反應,則炔烴只加 1 mol H
2 得Z型烯烴。例如:一個天然的含三鍵的硬脂炔酸,在該催化劑作用下,生成與天然的順型
油酸 完全相同的產物。
用
硫酸鋇 作載體的鈀催化劑在吡啶中也可以使碳碳三鍵化合物只加 1 mol H
2 ,生成順型的烯烴衍生物。這表明,催化劑的活性對催化加氫的產物有決定性的影響。炔烴的催化加氫是製備Z型烯烴的重要方法,在合成中有廣泛的用途。
硼氫化—炔烴與
乙硼烷 反應生成烯基硼烷,烯基硼烷與
醋酸 反應,生成Z型烯烴。第一步反應是炔烴的硼氫化反應,第二步反應是烯基硼的還原反應,總稱硼氫化—還原反應。
鹼金屬還原 炔類化合物在
液氨 中用
金屬鈉 還原,主要生成E型烯烴衍生物。
氫化鋁鋰 還原 炔烴用氫化鋁鋰還原也能得到E型烯烴。
氧化 炔烴經
臭氧 或高錳酸鉀氧化,可發生碳碳三鍵的斷裂,生成兩個
羧酸 。
在水和
高錳酸鉀 存在的條件下,溫和條件: PH=7.5時, RC≡CR' → RCO-OCR'
劇烈條件:100°C時,RC≡CR' → RCOOH + R'COOH
CH≡CR →
CO2 + RCOOH
末端炔烴 炔烴中C≡C的C是sp雜化,使得Csp-H的σ鍵的
電子云 更靠近碳原子,增強了C-H鍵極性使氫原子容易解離,顯示“酸性”。
電負性 :sp>sp2>sp3,酸性大小順序:乙炔>
乙烯 >
乙烷 。
連線在C≡C碳原子上的氫原子相當活潑,易被金屬取代,生成炔烴金屬衍生物叫做炔化物。
CH≡CH + Na → CH≡CNa + 1/2H
2 ↑(條件NH
3 )
CH≡CH + 2Na → CNa≡CNa + H
2 ↑ (條件NH
3 ,190℃~220℃)CH≡CH + NaNH
2 → CH≡CNa + NH
3 ↑
CH≡CH + Cu
2 Cl
2 (2AgCl) → CCu≡CCu( CAg≡CAg )↓ + 2NH
4 Cl +2NH
3 ( 注意 :只有在三鍵上含有氫原子時才會發生,用於鑑定端基炔RH≡CH)。
聚合反應 炔會發生
聚合反應 :2CH≡CH →CH
2 =CH-C≡CH (乙烯基乙炔) + CH≡CH →CH
2 =CH-C≡C-CH=CH
2 (二乙烯基乙炔)
乙炔在不同的
催化劑 作用下,可有選擇地聚合成鏈形或環狀化合物。例如在氯化亞銅或氯化銨的作用下,可以發生二聚或三聚作用,生成苯。但這個反應苯的產量很低,同時還產生許多其他的芳香族副產物,因而沒有製備價值,但為研究苯的結構提供了有力的線索。
除了三聚環狀物外,乙炔在
四氫呋喃 中,經
氰化鎳 催化,於1.5~2MPa、50℃時聚合,可產生環辛四烯。該化合物在認識芳香族化合物的過程中,起著很大的作用。以往認為乙炔不能在加壓下進行反應,因為它受壓後,很容易爆炸。後來發現將乙炔用氮氣稀釋,可以安全地在加壓下進行反應,因而開闢了乙炔的許多新型反應,製備出許多重要的化合物。環辛四烯就是其中一個。
結構鑑別 將乙炔通入銀氨溶液或亞銅氨溶液中,則分別析出白色和紅棕色炔化物沉澱。
其他末端炔烴也會發生上述反應,因此可通過以上反應,可以鑑別出分子中含有的—C≡CH
基團 。
和炔烴的氧化一樣,根據高錳酸鉀溶液的顏色變化可以鑑別炔烴,根據所得產物的結構可推知原炔烴的結構。
製備 炔烴的一般製備是通過鄰二鹵化烷烴的脫鹵化氫作用,也可以通過金屬炔化合物與一級鹵化烷反應製得。在Fritsch-Buttenberg-Wiechell重排中,炔烴又溴化
乙烯基 起始製得。
炔烴也可以由
醛 通過Corey-Fuchs反應製得,亦可以通過Seyferth-Gilbert同素化製得。
乙炔製作用煤或石油作原料,是生產乙炔的兩種主要途徑。隨著天然氣化學工業的發展,天然氣即將成為乙炔的主要來源。
電弧法 甲烷在1500℃電弧中經極短時間(0.1~0.01s)加熱,
裂解 成
乙炔 ,即:
2CH4 →C2 H2 +3H2 ΔH=397.4KJ/mol
由於乙炔在高溫很快分解成碳,故反應氣須用水很快
地 冷卻,乙炔產率約15%,改用氣流冷卻反應氣,可提高乙炔產率達25%~30%。裂解氣中還含有乙烯、氫和碳塵。這個方法的總特點是原料非常便宜,在天然氣豐富的地區採用這個方法是比較經濟的。
石腦油 也可用此方法生產乙炔。
電石法 CaO+3C<—2200℃—>CaC2 +CO ΔH=460KJ/mol
CaC2+2H2O——>C2H2+Ca(OH)2
此法成本較高,除少數國家外,均不用此法。
等離子法 用石油和極熱的氫氣一起熱裂製備
乙炔 ,即把氫氣在3500~4000℃的電弧中加熱,然後部分等離子化的電漿氫(正負離子相等)於電弧加熱器出口的分離反應室中與氣體的或氣化了的石油氣反應,生成的產物有:乙炔、乙烯(二者的總產率在70%以上)以及甲烷和氫氣。
乙炔過去是非常重要的有機合成原料,由於乙炔的生產成本相當高,以乙炔為原料生產化學品的路線逐漸被以其他化合物(特別是乙烯、丙烯)為原料的路線所取代。
純的乙炔是帶有
乙醚 氣味的氣體,具有麻醉作用,燃燒時火焰明亮,可用以照明。工業乙炔不好聞氣味是由於含有硫化氫、
磷化氫 、以及有機磷、硫化合物等雜質引起的。與乙烯、乙烷不同,乙炔在水中具有一定的溶解度,但易溶於丙酮。液化乙炔經碰撞、加熱可發生劇烈爆炸,乙炔與空氣混合、當它的含量達到3~70%時,會劇烈爆炸。商業上為安全地處理乙炔,把它裝入鋼瓶中,瓶內裝有多孔材料,如
硅藻 土、浮石或木炭,再裝入丙酮。丙酮在常壓下,約可溶解相當於它體積25倍的乙炔,而在1.2MPa下可溶解相當其體積300倍的乙炔。乙炔和
氧氣 混合燃燒,可產生2800℃的高溫,用以焊接或切割鋼鐵及其他金屬。
注意事項 1、乙炔與
烷烴 不同,炔烴不穩定且非常活躍,乙炔燃燒發出大量的熱,乙炔焰常被用來
焊接 。
2、炔化物乾燥後,經撞擊而發生強烈爆炸,生成金屬和碳。故在反應結束時,應加入稀
硝酸 使之分解。
4、乙炔不穩定、非常活躍。乙炔儲存要避免受熱。
6、乙炔與空氣混合,能形成爆炸性混合物,遇明火、高熱能引起燃燒、爆炸。
7、乙炔能與銅、銀、汞等的化合物生成爆炸性物質。
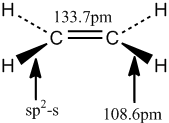 乙烯分子中鍵長
乙烯分子中鍵長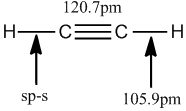 乙炔分子中鍵長
乙炔分子中鍵長

