病毒命名
本科
病毒的組成相當龐大, 成員複雜, 其中許多成員過去被稱為“
蟲媒病毒”(Arbovirus ),因為當時
披膜病毒科只包括甲病毒屬和黃病毒屬,幾乎所有成員均由節肢昆蟲傳播,故有此名。但必須指出,“蟲媒病毒”不是一個分類學名稱,它只是反映當時研究狀況的一個通俗但又
含糊的名稱,只能說明這類病毒由昆蟲傳播這一流行病學特徵。廣義上說,具有
蟲媒性質的病毒還包括另一些科或屬的病毒,如布尼安病毒科、環狀病毒屬和彈狀病毒科的某些成員以及非洲豬瘟病毒、某些呼腸孤病毒和痘病毒。 隨著病毒學的不斷發展, 披膜病毒科增加了許多新成員,它們多半並不具有蟲媒
傳播特性。所以,“蟲媒病毒”這一名稱現已不再使用,而命名為“披膜病毒科”(Togaviridae)。
病毒分類
有關病毒的分類,世界各國均以國際病毒分類委員會(ICTV)報告“病毒分類與命名”中的描述為準。最初的披膜病毒科只包括甲病毒屬(Alphavirus)和黃病毒屬(Flavivirus),在76年增加了風疹病毒屬(Rubivirus)和瘟病毒屬(Pestivirus),使該科病毒總計達4個屬。進一步研究發現黃病毒屬成員的基因組結構和基因轉錄過程,與甲病毒很不相同,於是1986年,在ICTV第三次報告中,將黃病毒屬從披膜病毒科抽出來,成立了一個獨立的病毒科——黃病毒科,而將動脈炎病毒屬(Arterivirus)納入,使其成為披膜病毒科的新成員。此後,瘟病毒的基因克隆研究發現, 該屬病毒的基因組結構及其表達方式與黃病毒十分相似,因此在1991年ICTV公布的第四次報告中,將瘟病毒屬納入黃病毒科,從而使披膜病毒科的成員減為3個屬。隨著分子病毒學的發展,病毒的基因組結構及其功能被不斷認識,所以各病毒的分類地位也在不斷調整之中,以便更加合理。最新研究表明,動脈炎病毒屬的基因組結構和複製方式與冠狀病毒相似,而與披膜病毒科成員相去甚遠,所以,在1995年ICTV的第五次報告中又將動脈炎病毒屬從披膜病毒科提出來,放入冠狀病毒科。但是這一分類地位可能只是暫時性的,因為,除基因組結構與複製方式外,動脈炎病毒與冠狀病毒有很大差別:其基因組大小和病毒粒子大小僅為冠狀病毒的一半;表面纖突相對較小而且不清楚,纖突蛋白的結構也不相同。所以有人建議成立動脈炎病毒科。本書鑒於動脈炎病毒屬的分類地位尚未最後確定,同時考慮到其傳統分類地位,所以仍將動脈炎病毒屬納入披膜病毒科進行討論。
病毒形態
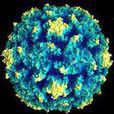
顧名思義,披膜病毒是一類具有囊膜的病毒,病毒粒子呈球狀,直徑在60~70nm之間,分子量約52×10.6kDa。在蔗糖密度梯度中的浮密度為:甲病毒,1.22g/cm?3; 風疹病毒,1.18~1.19g/cm?3;動脈炎病毒,1.13~1.17g/cm?3 。 甲病毒和風疹病毒的沉降係數約為280 S,動脈炎病毒的沉降係數約為200~230 S。核衣殼呈二十面立體對稱,直徑30~40nm,含單股線狀RNA基因組。病毒核酸分子量約4×10 .6kDa, 占病毒粒子總重量的8%~9%。 披膜病毒的蛋白質種類很少,病毒粒子只含3~4種蛋白質, 占病毒粒子重量的62%。病毒囊膜為雙層類脂膜,來源於細胞的胞漿膜,囊膜緊密包裹著核衣殼,表面有糖蛋白組成的纖突(長4~10nm)。病毒粒子一般只含有2種糖蛋白,E1和E2,分子量分別為45~53kDa和53~59kDa。某些甲病毒,如西門利克林病毒(Semliki forest virus,SFV),含有第三種糖蛋白E3,其分子量約10kDa。在病毒粒子上,糖蛋白E1和E2形成異二聚體,它們具有紅細胞吸附活性,含有中和性抗原表位,在甲病毒還含有血清型與亞型的特異抗原表位。這種異二聚體構成了病毒囊膜表面的纖突,在病毒粒子表面,每三個纖突組成1個三聚體(trimer),纖突排列成T=4二十面體晶格,恰好與衣殼蛋白組成的T=4二十面體立體對稱結構呈1對1的相應關係。因此,整個病毒粒子有240個纖突(形成80個三聚體)和240個衣殼蛋白單位。這樣的形態結構至少已在甲病毒屬成員,如辛德畢斯病毒,獲得證實。
理化特性
病毒核衣殼蛋白,也稱為核心蛋白(C),分子量為30~33kDa。序列分析表明, 辛德畢斯病毒C蛋白有一個類似於某些植物病毒核衣殼蛋白的結構:N端大約115個殘基帶正電荷,可能與病毒基因組RNA特異性地相互作用,以起始核衣殼的形成過程;其餘部分約150個殘基,與糖蛋白E2膜內的C端相連,這一區域在所有甲病毒都是保守的。
病毒的脂質來源於宿主細胞的胞漿膜,約占病毒粒子乾重的30%。 脂類的組成取決於病毒感染的細胞類型。磷脂與膽固醇的比例在甲病毒為2∶1,風疹病毒為4∶1。糖約占病毒粒子重量的6%,存在於糖蛋白中,主要有甘露糖和N聚糖(N linked glycan),此外,風疹病毒E2含有O聚糖(O linked glycan)。
甲病毒穩定存在於pH值7~8的環境,而在酸性條件下,則很快被滅活。大多數甲病毒對熱敏感,37℃時的半存活期為7小時, 但58℃時很快滅活。風疹病毒在37℃時的半存活期只有1~2小時,58℃時的半存活期為5~20分鐘。由於有脂質囊膜, 所有披膜病毒對有機溶劑(乙醚和氯仿等)和去污劑敏感。
基因組結構
披膜病毒基因組為單股正鏈RNA,沉降係數42~49S,5'端一般有帽結構,3'端有Poly(A)尾。基因組RNA具有感染性。在感染起始階段,病毒基因組可直接作為 mRNA,翻譯病毒複製所需的一些酶(非結構蛋白) 。核酸序列測定表明,甲病毒基因組大小為11~12kb;風疹病毒基因組大小約9?7kb(不包括3端Poly (A)尾);動脈炎病毒基因組12.5~15.1kb。披膜病毒基因組5端帽結構與真核mRNA相似,但也有其自身特點,如在甲病毒粒子中,基因組RNA 5端有O型帽結構(含m7G), 而在感染細胞中,甲病毒RNA除m7G帽結構外,少量病毒RNA還含有m2,7G和m2,2,7G的帽核苷酸。甲病毒RNA 3'端Poly (A)尾比真核mRNA和其它病毒RNA平均短70個nt。無Poly (A)尾的病毒RNA則沒有感染性。
甲病毒和風疹病毒基因組分為二個編碼區段,各含有一個長的開放閱讀框架。5'端2/3基因組編碼病毒的4種非結構蛋白,主要是病毒複製酶和轉錄酶。3'端1/3基因組編碼病毒的結構蛋白,即核心蛋白和糖蛋白。二個區段之間為非編碼的連線區。甲病毒連線區長40~50nt,含有結構蛋白mRNA的轉錄起始信號。其基因組5'端還有60~80nt長的非編碼區,3'端有121~524nt長的非編碼區。
病毒基因組有三個比較保守的區域:①5'端非編碼區有51nt長的保守序列,可形成發卡結構;② 3'端靠近Poly (A)尾有19nt長的保守序列,對從基因組轉錄有重要作用;③連線區內有21nt長的保守序列,可能是啟動子,啟動結構蛋白mRNA的轉錄。5'末端可形成一個比較保守的莖-環結構。
蛋白質合成
甲病毒感染細胞後,49S的基因組RNA即作為mRNA,首先翻譯出一個多聚蛋白前體,這一多聚蛋白被逐級酶解成4種非結構蛋白, 即 nsP1,nsP2,nsP3和nsP4, 它們在基因組上的順序為NnsP1nsP2nsP3nsP4C。nsP1 可能參與病毒RNA帽結構的形成以及起始負鏈RNA合成,nsP2既是非結構蛋白前體的蛋白酶,可能也是病毒RNA複製所需的螺旋酶,nsP3也是RNA複製所需要的,nsP4被認為是病毒RNA聚合酶。 這4種蛋白質構成了病毒複製酶/轉錄酶系統, 這對合成病毒基因組的負鏈拷貝和從負鏈轉錄病毒結構蛋白mRNA是非常必要的。
風疹病毒非結構蛋白加工的細節尚不清楚,但該病毒的非結構蛋白前體同樣有一些與甲病毒類似的具有螺旋酶、複製酶和蛋白酶功能的核心肽段,然而這些核心肽段在風疹病毒基因組上的排列順序不同於它們在甲病毒基因組上的排列順序。
病毒結構蛋白是由基因組負鏈轉錄的mRNA翻譯的,所以也叫晚期蛋白。甲病毒結構蛋白mRNA長約4 100nt,是亞基因組RNA,具有5'端帽結構和3'端Poly (A)尾,沉降係數26S,所以通常稱為26S RNA。其長度變化反映出各病毒成員基因組3?端非編碼區長度的不同。在感染細胞中,26S RNA 濃度很高,翻譯效率也很高。與49S RNA一樣,26S RNA先翻譯出一個多聚蛋白前體,一前體在剛合成時就立即被酶解,首先產生核心C蛋白。 研究表明這一酶解是由C蛋白自身催化的,因為它含有絲氨酸蛋白酶的活性位點。C蛋白產生後,餘下的蛋白前體在蛋白酶作用下裂解成3種糖蛋白(E1、E2和E3)和另一種6K的蛋白質。 這些蛋白質在基因組上的順序為N?C?E3?E2?6K?E1?C。C 蛋白形成後很快(5~7分鐘)就與病毒基因組RNA相結合,包裝成核衣殼。C蛋白的N 端一半與基因組RNA相結合。 C端一半參與核衣殼的形成,在病毒釋放過程中與糖蛋白間相互作用,此外還有自身蛋白酶活性。某些甲病毒如SFV有E3,其E2較小。大部分甲病毒的E2較大,因為E3成為E2的一部分,並沒有被加工切割。E2和E1形成功能性異二聚體,構成了病毒囊膜的纖突,E2的膜內區與核衣殼相結合,其膜外區帶有甲病毒主要中和性抗原位點。E1也有一個中和性抗原位點,其保守區有細胞融合特性,可吸附紅細胞,但E1和E2的抗體都能阻斷血凝反應。6K蛋白位於E2和E1之間,是一個內部的信號序列,可使E1進入內質網。E1與E2在進入時就被糖基化,然後通過高爾基體搬運到胞漿膜。動脈炎病毒的結構蛋白是由6種亞基因組mRNA翻譯的。
病毒複製
目前對披膜病毒複製的認識都基於對二種關係很近的甲病毒——辛德畢斯病毒(SINV)和SFV在哺乳動物細胞中增殖的研究結果。
披膜病毒的複製周期起始於病毒與易感細胞的結合,終止於新病毒從細胞膜釋放出來,該病毒的複製在胞漿中進行。在細胞中,病毒特異的生物學活動主要分三個階段: ①病毒基因組的複製;②病毒結構蛋白的合成與成熟;③病毒粒子裝配。
披膜病毒與細胞的結合是受體介導的,但目前尚未分離鑑定出這一特異受體。病毒與細胞的結合依賴於環境的pH值和離子強度( 較低的pH值和離子強度能促進病毒與細胞結合),或許更依賴於病毒與細胞間相對的電荷狀態。 病毒靠其囊膜表面的纖突與細胞結合,隨後通過細胞胞飲進入胞漿,在胞漿中被包裹形成酸性吞噬小體(endosome)。在低pH環境中,病毒囊膜與吞噬小體膜融合,從而導致病毒糖蛋白的構象改變,核衣殼隨後進入胞漿,並脫殼和釋放出基因組RNA。這就是甲病毒進入細胞的“吸附胞飲”(adsorptive endocytosis)機制。此外可能還存在其它進入細胞的機制,特別是在節肢昆蟲細胞中,形成這種酸性吞噬小體似乎並非甲病毒感染所必需。
病毒進入細胞約1小時後,脫衣殼的病毒RNA即作為mRNA合成4種非結構蛋白, 以起始病毒的複製。在複製過程中,基因組5和3端非編碼區以及26S RNA啟動子上游均存在一些順式調控元件,用於調控負鏈和正鏈RNA的合成。在感染細胞中, 存在49S和26S二種正鏈RNA。49S RNA既是基因組RNA,又是非結構蛋白的mRNA,26S RNA是結構蛋白mRNA, 它們均由全長負鏈拷貝轉錄而來。全長負鏈 RNA 的合成是病毒基因組RNA複製的開始, 感染後1小時即可發生。感染後約3小時,49S和26S RNA開始合成。新合成的49S RNA有3種歸宿:①作為mRNA 與細胞中的核糖體結合,從而合成病毒的非結構蛋白;② 作為模板,繼續複製全長負鏈拷貝;③與核心蛋白結合,包裝成核衣殼。在病毒RNA合成的整個過程中, 負鏈只占整個RNA合成量的10%,感染後5~6小時,負鏈合成即關閉,而正鏈的合成可在穩定的速率下繼續數小時。在感染早期,26S RNA量相對較多,到了後期49S RNA則相對占優勢。但在整個感染周期中,26S RNA占絕對優勢,其與49S RNA的克分子比為3∶1。49S RNA還要包裝成核衣殼,這樣在翻譯過程中,26S RNA與核糖體形成的複合物是49S RNA的10倍。所以在感染細胞中容易檢測到病毒結構蛋白,而非結構蛋白因合成量太少,加之它合成於感染早期(在細胞蛋白合成終止之前),故很難檢出和分離。感染後2小時,在感染細胞中即能檢測到病毒結構蛋白。其中C蛋白產生後,很快與病毒RNA結合,組裝成核衣殼。 結構性糖蛋白通過信號序列插入到內質網, 隨後轉運到高爾基體和胞漿膜,在轉運過程中被糖基化和酯醯化, 成為一種穿膜蛋白,最後與核衣殼包裝成病毒粒子,由細胞表面出芽釋放。
病毒感染可造成脊椎動物宿主細胞的蛋白質合成終止,從而導致細胞死亡( 溶細胞性感染)。但病毒感染並不造成蚊細胞蛋白質合成的終止, 因而蚊細胞免於死亡(非溶細胞性感染),病毒則形成持續性感染而長期生存。病毒在蚊細胞中的裝配似乎與在脊椎動物細胞中的不同。
根據宿主細胞和傳代條件的不同, 披膜病毒在高濃度傳代過程中可出現缺失干擾顆粒(DI顆粒),在DI顆粒中病毒RNA也是缺失的,大約只有正常RNA 一半,甚至1/5,這叫缺失RNA。缺失RNA常保留病毒複製與包裝的識別序列。