尖晶石型錳酸鋰LiMn2O4是Hunter在1981年首先製得的具有三維鋰離子通道的正極材料,至今一直受到國內外很多學者及研究人員的極大關注,它作為電極材料具有價格低、電位高、環境友好、安全性能高等優點,是最有希望取代鈷酸鋰LiCoO2成為新一代鋰離子電池的正極材料。
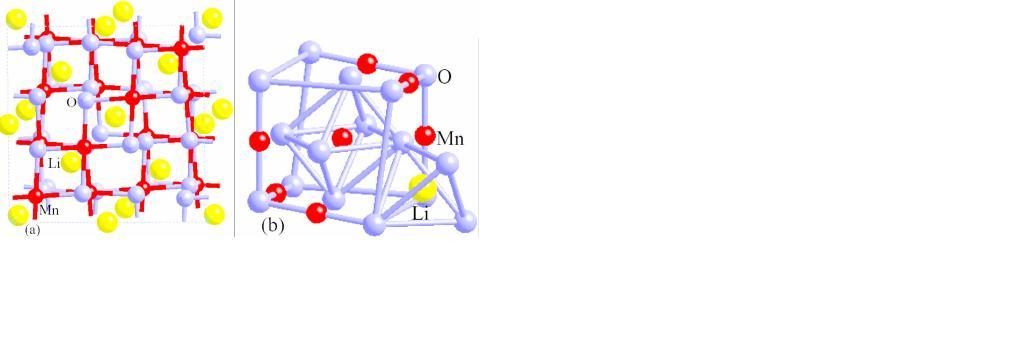
尖晶石型錳酸鋰LiMn2O4是Hunter在1981年首先製得的具有三維鋰離子通道的正極材料,至今一直受到國內外很多學者及研究人員的極大關注,它作為電極材料具有價格低、電位高、環境友好、安全性能高等優點,是最有希望取代鈷酸鋰LiCoO2成為新一代鋰離子電池的正極材料。

尖晶石型錳酸鋰LiMn2O4是Hunter在1981年首先製得的具有三維鋰離子通道的正極材料,至今一直受到國內外很多學者及研究人員的極大關注,它作為電極材料具有價格低、電位高...
錳酸鋰主要為尖晶石型錳酸鋰 尖晶石型錳酸鋰LiMn2O4是Hunter在1981年首先製得的具有三維鋰離子通道的正極材料,至今一直受到國內外很多學者及研究人員的極大關注,它...
鎳錳酸鋰主要為尖晶石型鎳錳酸鋰,化學式可表示為LiNi0.5Mn1.5O4,與另一種也稱作鎳錳酸鋰的二元層狀結構化合物(化學式LiNi0.5Mn0.5O2)是兩種結構體系的鋰...
新型混合形水系鋰離子電池/電容器具有比能量和非常長的循環壽命,例如採用活性炭負極、尖晶石型錳酸鋰正極和1M Li2SO4水溶液電解質組成的混合型電容器 (AC/LiMn2O4...
電動汽車用鋰離子二次電池第1章 動力鋰離子二次電池材料1.1 層狀岩鹽結構正極材料1.2 尖晶石結構錳酸鋰正極材料1.3 天然石墨負極材料...
2、 力虎林,張校剛,包淑娟,賀本林,梁彥瑜,周文佳,張國慶,“鋰離子電池正極材料用尖晶石型錳酸鋰的合成方法”,授權專利號:。3、 包淑娟,雷超,“一種綠色仿生...
長循環壽命橄欖石型磷酸鐵鋰;高比容量、長高溫循環壽命改性尖晶石型錳酸鋰;高能量密度、高安全性、長循環壽命改性層狀鎳鈷鋁酸鋰(NCA)及其衍生產品;高比容量、長...
14.2層狀岩鹽型氧化物的正極材料14.3錳酸鋰正極材料——尖晶石型錳酸鋰14.4橄欖石型正極材料進一步閱讀的參考書思考題第15章多孔材料催化劑的合成與製備...
5. 康雪雅, 韓英,王天雕,鋰離子蓄電池正極活性材料尖晶石型錳酸鋰的製備方法,國家發明專利,20056. 康雪雅, 韓英,王天雕,鋰離子電池正極材料錳酸鋰的微波合成...
