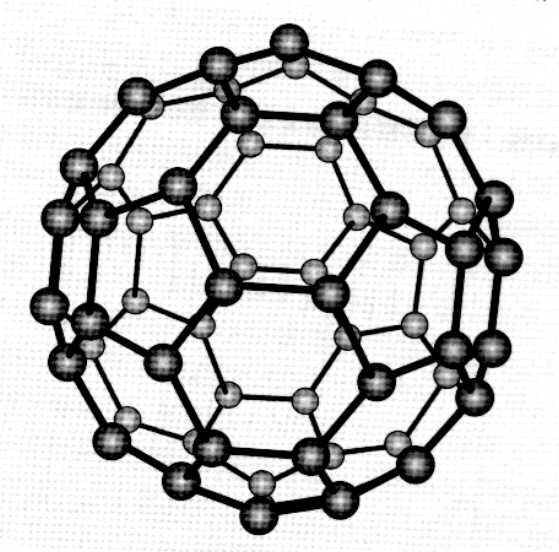
富勒碳(fullerenes)是指碳的同素異形體中的一大類,由五員碳環及六員碳環互相連線構成的封閉空心球狀碳分子。富勒碳又稱球碳、球苯、富勒烯、巴基球等,按諧音簡稱富勒可能最為便捷。富勒碳的著名代表是由20個六員環及12個五元環,相間分布、互相連線而成的60C,及由12個五員環和25個六員環構成的70C。
基本介紹
- 中文名:富勒碳
- 外文名:fullerenes
- 學科:冶金工程
- 領域:能源
- 範圍:冶煉
- 別稱:球碳
簡介,富勒烯的分類,富勒烯的結構,富勒烯的性能,
簡介
富勒烯(Fullerene)是一種完全由碳組成的分子,中空,形狀呈球型、橢球型、柱型或管狀。本文主要從富勒碳的結構、性能、套用前景等方面來介紹富勒碳。富勒碳有C60、碳納米管等結構,不同的富勒碳結構具有不同的性能和套用前景。
富勒烯(Fullerene) 是一種碳的同素異形體。任何由碳一種元素組成,以球狀,橢圓狀,或管狀結構存在的物質,都可以被叫做富勒烯。富勒烯與石墨結構類似,但石墨的結構中只有六元環,而富勒烯中可能存在五元環。1985年Robert Curl等人製備出了C60。1989年,德國科學家Huffman和Kraetschmer的實驗證實了C60的籠型結構,從此物理學家所發現的富勒烯被科學界推向一個嶄新的研究階段。1985年英國化學家哈羅德·沃特爾·克羅托博士和美國科學家理察·斯莫利在萊斯大學製備出了第一種富勒烯,即富勒烯分子。飯島澄男早在1980年之前就在透射電子顯微鏡下觀察到這樣洋蔥狀的結構。自然界也是存在富勒烯分子的,2010年科學家們通過史匹哲太空望遠鏡發現在外太空中也存在富勒烯。 “也許外太空的富勒烯為地球提供了生命的種子”。在富勒烯的發現之前,碳的同素異形體的只有石墨、鑽石、無定形碳(如炭黑和炭),它的發現極大地拓展了碳的同素異形體的數目。它具有極其特異的電化學特性、吸附氣體特性以及機械和光學特性,因而受到世界各國科學界的高度重視。各國科學家正在嘗試將它套用於醫藥、能源、化學、環保、電子、化妝品及機械等工業領域。
富勒烯的分類
富勒烯有以下分類:
巴基球團簇:最小的是C20 (二十烷的不飽和衍生物)和最常見的C60;
碳納米管:非常小的中空管,有單壁和多壁之分;在電子工業有潛在的套用;
巨碳管:比納米管大,管壁可製備成不同厚度,在運送大小不同的分子方面有潛在價值;
聚合物:在高溫高壓下形成的 鏈狀、二維或三維聚合物。
納米“洋蔥”:多壁碳層包裹在巴基球外部形成球狀顆粒,可能用於潤滑劑;球棒相連二聚體:兩個巴基球被碳鏈相連;富勒烯環。
富勒烯的結構
在數學上,富勒烯的結構都是以五邊形和六邊形面組成的凸多面體。最小的富勒烯是C20,有正十二面體的構造。沒有22個頂點的富勒烯,之後都存在C2n的富勒烯,n=12、13、14……所有富勒烯結構的五邊形個數為12個,六邊形個數為n-10。
1.C60
C60及其相關C70兩者都滿足這種所謂的孤立五角規則(IPR)。而C84的異構體中有24個滿足孤立五角規則的,而其他的51568個異構體則不滿足孤立五角規則,這51568 為非五角孤立異構體,而不滿足孤立五角規則的富勒烯迄今為止只有幾種富勒烯被分離得到,比如分子中兩個五邊形融合在頂尖的一個蛋形籠狀內嵌金屬富勒烯Tb3NaC84。或具有球外化學修飾而穩定的富勒烯如C50Cl10,以及C60H8。
2.C70
理論計算表明C70的LUMO軌道是一個二重簡併軌道,不過它的LUMO+1軌道與LUMO軌道的能級差很小,因此它可以得到至少六個電子,常規的循環伏安和差示脈衝伏安法檢測只能得到4個還原電勢,而在真空條件下使用乙腈和甲苯的1:5的混合溶劑可以得到六個還原電勢的譜圖。
3.低對稱性富勒烯
低對稱性富勒烯的鍵長是不一樣的,雖然也是離域π鍵,從核磁共振碳譜可以清楚看出來有很多條碳信號。
4.手性
一些富勒烯是D2對稱性的,因此他們是有固有手性的,如 C76、C78、C80和C84等,科學家一直致力於發展特別的感測器來識別和分離他們的對映異構體。
富勒烯的性能
1.溶解性:富勒烯在大部分溶劑中溶得很差,通常用芳香性溶劑,如甲苯、氯苯,或非芳香性溶劑二硫化碳溶解。純富勒烯的溶液通常是紫色,濃度大則是紫紅色,C70的溶液比C60的稍微紅一些,因為其他在500nm處有吸收;其他的富勒烯,如C76、C80等則有不同的紫色。富勒烯是迄今發現的唯一在室溫下溶於常規溶劑的碳的同素異性體。
有些富勒烯是不可溶的,因為他們的基態與激發態的頻寬很窄,如C28,C36和C50。C72也是幾乎不溶的,但是C72的內嵌富勒烯,如La2@C72是可溶的,這是因為金屬元素與富勒烯的相互作用。早期的科學科學家對於沒有發現C72很是疑惑,但是卻有C72的內嵌富勒烯。窄頻寬的富勒烯活性很高,經常與其他富勒烯結合。
2.導電性:碳原子本具有導電性,而C60分子的導電性優於銅,重量只有銅的六分之一, 一個巴克球分子相當於一納米,可謂極微小,它的導電性來自奇特的分子結構並非靠其他原子, 可見不久的將來人類世界將誕生非金屬電纜、非金屬電路板...等富勒烯產品
3.熱力學性質:差示掃描量熱法(DSC)表明C60在256K時發生相變,熵為27.3J.K−1.mol−1,歸因於其玻璃形態-晶體轉變,這是典型的導向無序的轉變。相似地,C70在275K、321K和338K也發生無序轉變,總熵為22.7 J.K−1.mol−1。富勒烯的寬的無序轉變與從起始較低的溫度的類跳躍式旋轉向各向同性的旋轉漸變有關。
4.化學性質
富勒烯是穩定的,但並不是完全沒有反應性的。石墨中sp2雜化軌道是平面的,而在富勒烯中為了成管或球其是彎曲的,這就形成了較大的鍵角張力。當它的某些雙鍵通過反應飽和後,鍵角張力就釋放了,如富勒烯的[6,6]鍵是親電的,將sp2雜化軌道變為sp3雜化軌道來減小鍵張力,原子軌道上的變化使得該鍵從sp2的近似120°成為sp3的約109.5°,從而降低了C60球的吉布斯自由能而穩定。富勒烯即可以形成單加成產物,也可以形成多加成產物。 富勒烯化學是研究富勒烯的化學性質的科學。功能化富勒烯從而調節其性質的需求促使人們在這個領域展開了大量的研究。例如,富勒烯的溶解度很差,而添加合適的官能團可以提高其溶解度。通過添加一個可以發生聚合的官能團,就可以獲得富勒烯聚合物。富勒烯的功能化以分為兩類:在富勒烯的籠外進行化學修飾;將分子束縛到富勒烯球內,也就是開孔反應。
5.周環反應:勒烯的[6,6]鍵可以與雙烯體或親雙烯體反應,如D-A反應。[2+2]環加成可以形成四元環,如苯炔。偶極環加成反應可以生成五元環,被稱作Prato反應。富勒烯與卡賓反應形成亞甲基富勒烯。
6.加氫(還原)反應:氫化富勒烯產物如C60H18、C60H36。然而,完全氫化的C60H60僅僅是假設產物,因為分子張力過大。高度氫化後的富勒烯不穩定,而富勒烯與氫氣直接在高溫條件下反應會導致籠結構崩潰,而形成多環芳烴。
7.氧化反應:富勒烯及衍生物在空氣中會被慢慢的氧化,這也是通常情況下富勒烯需要在避光或低溫中保存的原因。富勒烯與三氧化鋨和臭氧等反應;與臭氧的反應很快很劇烈,可以生成羥基多加成的富勒醇混合物,因為加成數和加成位置有很寬的分布。
8.羥基化反應:富勒烯可以通過羥基化反應得到富勒醇,其水溶性取決於分子中羥基數的多少。一種方法是富勒烯與稀硫酸和硝酸鉀反應可生成C60(OH)15,另一種方法是在稀氫氧化鈉溶液的催化下反應由TBAH增加24到26個羥基。羥基化反應也有過用無溶劑氫氧化鈉與過氧化氫和富勒烯反應的報導。用過氧化氫與富勒烯的反應合成C60(OH)8,羥基的最大數量,可以達到36至40個。
9.親電加成:富勒烯也可以發生親電反應,比如在富勒烯球外加成24個溴原子,最多親電加成紀錄保持者是C60F48。
10.配位反應:富勒烯的五元環和六元環可以作為金屬配合物的配體,尤其是五元環,可以形成各種茂配合物。 [6,6]雙鍵是缺電子的,通常與金屬成鍵為η= 2(配位化學中的哈普托數)。鍵合模式如η= 5或η=6與球狀富勒烯配體有關。陽光直接照射富勒烯和硫羰基鎢W(CO)6的環己烷溶液生成(η2-C60)5 W(CO)6。
11.開孔反應:開孔反應是指通過化學手段選擇性地切斷富勒烯骨架上的碳碳鍵來製備開孔富勒烯的反應,開孔後就可能把一些小分子裝到碳球中,如氫分子、氦、鋰等。第一個開孔富勒烯是在1995由伍德等報導的。
12.碳納米管
由於碳納米管中碳原子採取sp2雜化,相比sp3雜化,sp2雜化雜化中s軌道成分比較大,使碳納米管具有高模量、高強度。碳納米管的硬度與金剛石相當,卻擁有良好的柔韌性,可以拉伸。在工業上常用的增強型纖維中,決定強度的一個關鍵因素是長徑比,即長度和直徑之比。材料工程師希望得到的長徑比至少是20:1,而碳納米管的長徑比一般在1000:1以上,是理想的高強度纖維材料。此外,碳納米管的熔點是已知材料中最高的。在碳納米管的內部可以填充金屬、氧化物等物質,這樣碳納米管可以作為模具,首先用金屬等物質灌滿碳納米管,再把碳層腐蝕掉,就可以製備出最細的納米尺度的導線,或者全新的一維材料,在未來的分子電子學器件或納米電子學器件中得到套用。有些碳納米管本身還可以作為納米尺度的導線。這樣利用碳納米管或者相關技術製備的微型導線可以置於矽晶片上,用來生產更加複雜的電路。利用碳納米管的性質可以製作出很多性能優異的複合材料。碳納米管還給物理學家提供了研究毛細現象機理最細的毛細管,給化學家提供了進行納米化學反應最細的試管。碳納米管上極小的微粒可以引起碳納米管在電流中的擺動頻率發生變化,利用這一點,可以製作能稱量單個原子的“納米秤”。
富勒烯及其衍生物物理性質的套用是多方面的。早在1991年,阿萊芒等人發現C60絡合物可以在沒有金屬存在的情況下表現出鐵磁性特徵,從而有希望開拓磁性記憶材料的一個新方向。用C60還能在CaAs晶體基質上製成C60-K3C60異質結膜,並可將其用於微電子器件等方面。隨著研究的深入,富勒烯獨特的物理性質將為其套用開闢一個廣闊的領域。
富勒烯由於其獨特的結構和化學物理性質,已對化學、物理、材料科學產生了深遠的影響,在套用方面顯示了誘人的前景。隨著研究的不斷深入,碳原子簇將要給人類帶來巨大的財富。