溶度積規則:當溶液中的離子濃度([Am+]m)的乘積等於溶度積(L)時,則溶液是飽和的;若小於其溶度積時,則沒有沉澱生成;若大於其溶度積時,會有AnBm化合物的沉澱析出。
基本介紹
- 中文名:溶度積規則
- 對象:溶液中的離子濃度
- 公示:[Am+]·m=L
- 性質:在多相離子平衡中的套用
基本定義
基本舉例
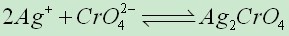
溶度積規則:當溶液中的離子濃度([Am+]m)的乘積等於溶度積(L)時,則溶液是飽和的;若小於其溶度積時,則沒有沉澱生成;若大於其溶度積時,會有AnBm化合物的沉澱析出。
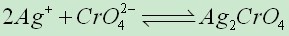
溶度積規則:當溶液中的離子濃度([Am+]m)的乘積等於溶度積(L)時,則溶液是飽和的;若小於其溶度積時,則沒有沉澱生成;若大於其溶度積時,會有AnBm化合物的...
溶度積是指難溶電解質儘管難溶,但還是有一部分陰陽離子進入溶液,同時進入溶液的陰陽離子又會在固體表面沉積下來,當這兩個過程的速率相等時,難溶電解質的溶解就...
沉澱在溶液中達到沉澱溶解平衡狀態時,各離子濃度保持不變( 或一定) ,其離子濃度冪的乘積為一個常數,這個常數稱之為溶度積常數,簡稱溶度積。溶度積與溶解度都...
Ksp沉澱平衡常數 (solubility product constant)Ksp簡稱溶度積.難溶電解質在水中會建立一種特殊的動態平衡。難溶電解質儘管難溶,但還是有一部分陰陽離子進入溶液,...
以上規則稱為溶度積規則。沉澱的生成和溶解這兩個相反的過程它們相互轉化的條件是離子濃度的大小,控制離子濃度的大小,可以使反應向所需要的方向轉化。...
5.1.2溶度積和溶解度(課堂討論) / 059 5.1.3溶度積規則 / 061 5.2沉澱-溶解平衡的移動 / 061 5.2.1沉澱的生成 / 062 5.2.2分步沉澱 / 062 5...
5.4.1 溶度積5.4.2 溶度積規則5.4.3 同離子效應和鹽效應5.4.4 分步沉澱和沉澱的轉化5.5 現代分離技術簡介5.5.1 固體膜分離技術簡介...
稱為溶度積以 KSP表示。 對於MmNn固體⇄mMn++nNm-,處於多相離子平衡狀態時,KSP=[Mn+]m[Nm-]n,溶度積的大小與物質的溶解度有關。利用溶度積規則,可以...
溶度積規則---用於判斷沉澱平衡移動的方向,即van’t Hoff等溫式在沉澱溶解平衡中的套用。根據溶度積常數,可以判斷某一難溶電解質的多相系統中沉澱 、溶解過程...
64 溶度積規則的套用176641 判斷沉澱的生成176642 沉澱的溶解178643 分步沉澱179644 沉澱的轉化181習題181第7章 沉澱平衡原理在分析化學中的套用--重量分析法184...
一、溶度積規則158 二、沉澱完全的條件160 三、分步沉澱161 四、沉澱的轉化162 五、沉澱劑的選擇163 第二節沉澱滴定——銀量法164 一、莫爾法——鉻...
12 1 1溶度積20512 1 2溶度積與溶解度的關係20512 1 3溶度積規則20612 2沉澱的生成20712 3沉澱的溶解20912 4分步沉澱210...
3.3.2 溶度積規則及其套用 3.4 膠體與界面化學 3.4.1 膠體的結構與穩定性 3.4.2 膠體的聚沉與保護 3.4.3 表面活性劑 3.4.4 膜化學 3.5 水污染及...
附錄4 難溶電解質的溶度積常數 附錄5 弱酸、弱鹼的電離常數(25%) 附錄6...編輯規則 本人編輯 我有疑問 內容質疑 線上客服 官方貼吧 意見反饋 投訴建議 舉報...
6.3.2溶度積規則及其套用96 本章內容小結98 習題100 第7章配位化合物及配位平衡103 7.1配位化合物103 7.1.1配位化合物的組成103 7.1.2配位化...
溶度積 3.4.2 同離子效應與鹽效應 3.4.3 溶度積規則的套用 3.5 氧化還原平衡 3.5.1 氧化還原反應的配平(離子一電子法) 3.5.2 原電池和電極電勢 3.5.3...
3.2.3 溶度積規則523.2.4 影響沉澱反應的因素523.2.5 分步沉澱543.2.6 沉澱的溶解與轉化553.3 配合物及水溶液中的配位平衡56...
