定義
反應方向(reaction direction)是指
反應物和生成物均處於
標準態時反應進行的方向。
影響因素
焓變
化學反應中所吸收或放出的能量有多種形式:熱能、光能、聲能和電能等。其中所吸收或放出的熱量稱為反應熱(或熱效應)。眾所周知,反應熱不僅與反應物的組成、結構、和性質有關,而且與其狀態和用量,以及反應條件(如溫度和壓力等)有關,熱力學上將反應前後溫度和壓力都不變的反應稱為恆溫恆壓反應。樹如,人體內進行的一系列反應,基本上是恆溫恆壓反應。恆壓反應的反應熱在數值上等於反應焓變。
對於反應焓變,可作如下理解:反應的吸熱或放熱表明,反應物和產物各自有不同的“焓”(H),當反應物的焓比產物的焓高(多)時,由反應物變成產物,就要釋放出那多餘的部分。則反應焓變(△H)為:
△H=H終態—H始態=H產物—H反應物
若H產物<H反應物,則 △H<0,即為放熱反應
若H產物>H反應物,則 △H>0,即為吸熱反應
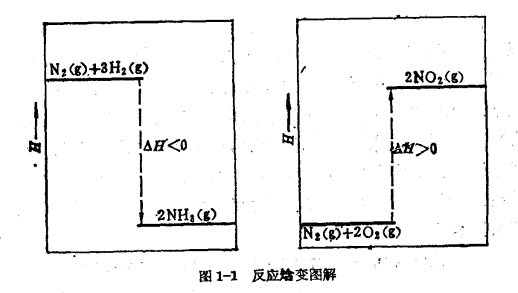
例如,下列兩個反應,若進行恆溫恆壓反應(T=298.15 K,p=101. 325kPa),各自的焓變為(g表示氣態)。
N2(g)+8H2(g)→2NH3(g)
△H=[2×H(1molNH3,g)]―[1×H(1molN2,g)+3×H(1molH2,g)]=-92.38kj/mol
N2(g)+2O2(g)→2NO2(g)
△H=[2×H(1molNO2,g)]―[1×H(1molN2,g)+2×H(1molO2,g)]=+67.70kj/mol
許多化學反應都是向著能量降低的方向進行。而放熱是系統能量降低的一種方式,即放熱有利於反應的自發進行。所以起初有人提出用焓變做為判斷反應方向的依據,即△H<o的反應能自發進行。然而,凍的溶化,KNO。溶於水都是吸熱過程,在常溫下卻能自發進行。而CaCO3。的分解也是吸熱反應,在常溫下不能自發進行,而高溫時,卻能自發進行了。可見只用焓變作為反應自發性的判據是不夠的。
熵變
混亂度是指系統內質點混亂的程度,即組成物質的質點在指定空間內排列和運動的無序程度。系統的混亂度越高即有序度越差。大量的實驗證明,在孤立系統中,自發過程總是混亂度增加的過程。
例如,硝酸銨等鹽類的溶解。晶體NH4NO3中正、負離子整齊而有序地排列,到它進入水中時,正、負離子向水中擴散而自由運動,而水分子同時也擴散到正、負離子間,最終成為均勻的溶液。和溶解前相比i溶液的溫度降低(吸熱過程),同時溶液中粒子的運動狀態要比溶質和純溶劑中更為混亂。
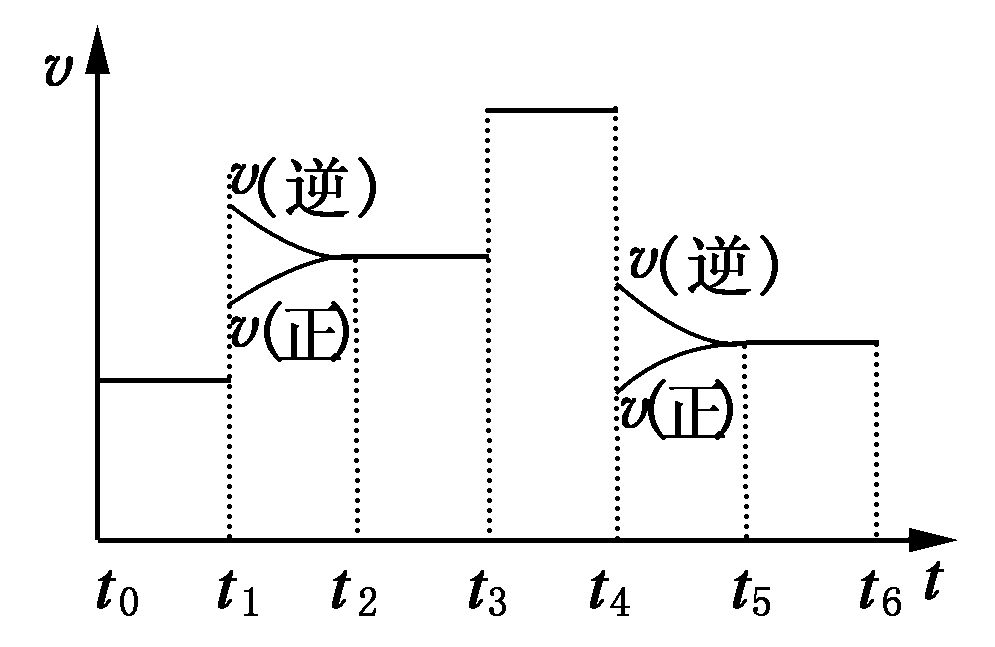
又如,理想氣體的擴散。,如圖(2一l)所示。有兩個玻璃容器,分別裝入不同的理想氣體A、B各一種,再由活塞相連線。,當活塞打開後;兩容器中的氣體A,B就相互擴散,最後成為均勻的混合物。這也是一種自發過程,整個過程中,溫度、壓力等都沒有變化,變化的只是從單純的氣體成為混合氣體,即整個體系粒子的運動狀態比原來更加混亂。
在上述兩個例‘中,第一例的溶解過程,既有能量交換因素(吸熱或放熱),又有混亂增加的因素。第二例中自發過程是向混亂度增加的方向進行。
總之,可見影響物理、化學過程自發性的因素有兩個,一是能量因素,另’一個則是體系的混亂度變化因素。任何自發過程都傾向於:a降低體系的能量;b.增加體系的混亂度。
體系中微觀粒子的任何微觀性質,都必然表現為體系一定的巨觀性質。正如體系中粒子平均動能的總表現為體系的溫度一樣,體系混亂度的巨觀量度稱熵,用符號s表示。體系的混亂度小或處在較有秩序的狀態,其熵值小;混亂度大或狀態較無秩序,對應的熵值就大。
體系的狀態一定,其混亂度的大小就一定,相應地,必有一個確定的熵值。因此,熵也是體系的一個狀態函式,是反映體系中粒子運動的混亂程度的一個物理量。
根據上述熵的物理意義,可得出如下結論:
a.對同一物質而言,氣態時的熵值要比液態時大,液態的熵值又大於固‘態,因為從固態到液態再到氣態,粒子運動的混亂度依次增加,熵值必然依次增大,即
S氣>S液>S固
b.對同一物質的同一聚集狀態而言,溫度升高,粒子熱運動增加,
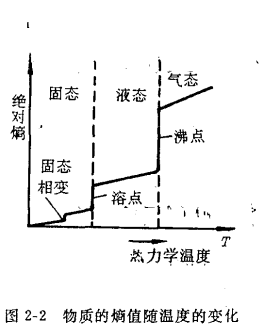
體系的混亂度增大,熵值也將增大。如圖2-2所示,即S高溫>S低溫
c.壓力降低時,氣體體積增大,粒子在較太的空間運動,
其混亂度必增大,所以低壓氣體的熵值要比高壓氣體的大,即
S低氣壓>S高氣壓
d·不同物質的熵值不同,與其分子的組成和結構有關。一般而言,
分子越大,結構越複雜,其運動情況也越複雜,混亂度就越大,
熵值也越大。
吉布斯能
雖然熵增有利於反應的自發進行,但是與反應焓變一樣,不能僅用熵變作為反應自發性的判據。例如SO
2(g)氧化為SO
3(g)的反應在298.15K、標準態下是一個自發反應。但其△
rS
m<o。又如水轉化為凍的過程,其△
rS
m<0,但在T<278.15K的條件下卻是自發過程。這表明過程(或反應)的自發性不僅與焓變和熵變有關,而且還與溫度條件有關。
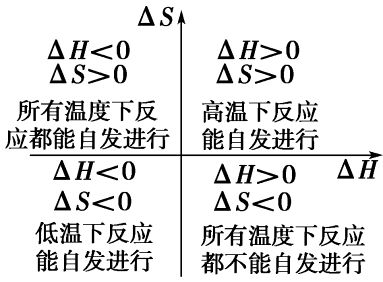
為了確定一個過程(或反應)自發性的判據,美國著名物理化學家
吉布斯(J.w.Gibbs)綜合考慮了系統的H、S以及溫度這三者之間的關係,提出了一個新的狀態函式,稱為吉布斯自由能,用G表示。G=H-TS
△G=△H-T△S稱為吉布斯公式
吉布斯提出:在恆溫、恆壓條件下,A,G。可作為反應(過程)自發性的判斷。即
△G<0, 自發過程
△G=o, 平衡狀態
△G>0, 非自發過程
恆溫、恆壓下,任何自發過程總是朝著吉布斯自由能(G)減小的方向進行。△rGm=0時,反應達平衡,體系的G降低到最小值。此即為著名的最小自由能原理。