化學反應限度就是研究可逆反應在一定條件下所能達到的最大程度,也即化學反應動態平衡。
基本介紹
- 中文名:化學反應限度
- 別稱:化學反應動態平衡
- 表達式:.v正=v逆
- 套用學科:化學
- 適用領域範圍:可逆反應
相關知識
基本概念
狀態與限度
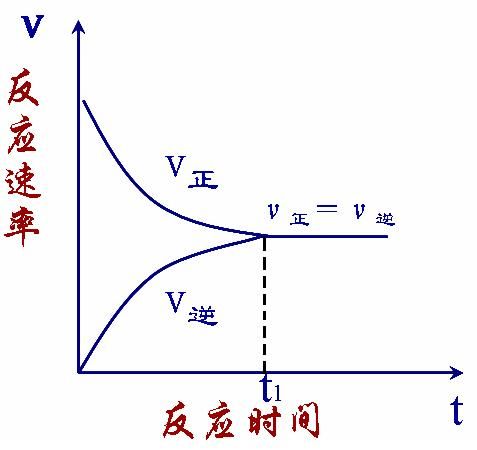

化學反應限度就是研究可逆反應在一定條件下所能達到的最大程度,也即化學反應動態平衡。

化學反應限度就是研究可逆反應在一定條件下所能達到的最大程度,也即化學反應動態平衡。...
化學反應是指分子破裂成原子,原子重新排列組合生成新分子的過程,稱為化學反應。在反應中常伴有發光發熱變色生成沉澱物等,判斷一個反應是否為化學反應的依據是反應是否...
第3章 化學反應的限度——化學平衡3.1 化學反應平衡的條件3.1.1 化學反應的方向和限度3.1.2 化學反應的標準摩爾吉布斯自由能[變]...
“化學反應的限度”和“溶液中的離子行為”四個版塊的探究實驗;化學探索研究篇可配合開設的“研究性學習”、“化學與生活”課,讓學生探索研究一些力所能及的與...
化學平衡是指在巨觀條件一定的可逆反應中,化學反應正逆反應速率相等,反應物和生成物各組分濃度不再改變的狀態。可用ΔrGm=ΣνΑμΑ=0判斷,μA是反應中A物質...
第2章化學反應的方向、限度與速率 第1節 化學反應的方向 第2節 化學反應的限度 第3節 化學反應的速率 第4節 化學反應條件的最佳化——工業合成氨 第3章...
反應比速率,氧化鈣脫硫反應中的化學反應動力學速率與二氧化硫、氧氣分子的擴散速率是一個難題。...
《普通化學(第6版)》是2011年高等教育出版社出版的圖書,作者是浙江大學普通化學...2.1.2反應自發性的判斷2.2化學反應的限度和化學平衡2.2.1反應限度和平衡...
2.1.1 影響反應方向的因素 2.1.2 反應自發性的判斷 2.1.3 反應的摩爾吉布斯函式變的計算及套用 2.2 化學反應進行的程度和化學平衡 2.2.1 反應限度的判據...
專題2化學反應與能量轉化第一單元化學反應速率與反應限度……詞條標籤: 文化, 出版物 圖集 化學(高1下必修2蘇教版)圖冊 V百科往期回顧 詞條統計 瀏覽次數:次...
在一定條件下,當一個可逆反應的正反應速率與逆反應速率相等時,反應物的濃度與生成物的濃度不再改變,達到一種表面靜止的狀態,即"化學平衡狀態". 其中,正反應速率...
原子經濟性是綠色化學以及化學反應的一個專有名詞。綠色化學的“原子經濟性”是指在化學品合成過程中,合成方法和工藝應被設計成能把反應過程中所用的所有原材料盡...
化學分析法是以物質 的化學反應為基礎的一種經典分析方法。法醫毒物分析中常用的化學分析法有:微量顯色反應(主要有酸鹼反應、氧化還原反應、 絡合反應等)、微量...
化學熱力學是物理化學和熱力學的一個分支學科,它主要研究物質系統在各種條件下的物理和化學變化中所伴隨著的能量變化,從而對化學反應的方向和進行的程度作出準確的...
再結合必要的化學數據,解決化學變化、物理變化的方向和限度,這也是化學熱力學的...)是指:在標準狀態下,由指定元素單質生成 1mol純物質時反應的吉布斯自由能變化,...
有機雜質的檢測方法包括化學法、光譜法、色譜法等,因藥物結構及降解產物的不同...當研究證明某些藥物中的雜質與不良反應有關,則應在制訂該雜質的限度時引起重視,...
《工科化學與實驗》是2009年華中科技大學出版社 出版的圖書 。本書主要內容包括了物質的聚集狀態、化學反應進行的方向及限度、化學動力學、溶液中的離子平衡、氧化...
反應歷程是指化學反應中的反應物轉化為最終產物通過的途徑。通過了解反應歷程,可以找到相應的主反應和副反應,從而找出決定反應速率的關鍵,達到生產中多快好省的目的...
具有危險化學反應:和氧氣發生強烈反應,並且產生燃燒和爆炸 短期接觸作用:該物質刺激...與空氣混合比例臨界限度%的空氣:1.1-7.1 氯辛醇/水的對數值:2.69 ...
這方面的問題都可套用熱力學第一定律來解決,並用它來計算化學變化中的熱效應。二是研究在一定條件下,化學反應進行的方向和限度,這可由熱力學第二定律來解決。...
在特定條件下(如溫度、壓力、溶劑性質、離子強度等),可逆化學反應達到平衡狀態時生成物與反應物的濃度(方程式係數冪次方)乘積比或反應產物與反應底物的濃度(方程式...
