基本介紹
- 中文名:化學計量化合物
- 外文名:chemical stoichiometric compound
- 別稱:整比化合物或道爾頓體
- 所屬學科:化學
簡介,AX型結構,NaCl型結構,CsCl型結構,立方ZnS(閃鋅礦)型結構,六方ZnS(纖鋅礦)型結構,AX2型結構,螢石(CaF2)型結構及反螢石型結構,金紅石(TiO2)型結構,碘化鎘(CdI2)型結構,A2X3型結構,AX3和A2X5型結構,ABO3型結構,鈦鐵礦型結構,鈣鈦礦型結構與鐵電效應,ABO4型(白鎢礦型)結構及聲光效應,AB2O4型(尖晶石)結構,石榴石結構,
簡介
AX型結構
AX型結構主要有CsCl,NaCI,ZnS,NiAs等類型,其鍵性主要是離子鍵,其中CsCI和NaCl是典型的離子晶體,NaCl晶體是一種透紅外材料,ZnS帶有一定的共價鍵成分,是一種半導體材料,NiAs晶體的性質接近於金屬。大多數AX型化合物的結構類型符合正負離子半徑比與配位數的定量關係。
NaCl型結構
NaCl屬於立方晶系(見圖1),晶胞參數的關係是a=b=c,α=β=γ=90°,點群m3m,空間群Fm3m。結構中Cl-為面心立方最緊密堆積,Na+填充八面體空隙的100%;兩種離子的配位數均為6;一個晶胞中含有4個NaCl分子,整個晶胞由Na+和Cl-各一套面心立方格子沿晶胞邊棱方向位移1/2晶胞長度穿插而成。NaCl型結構在三維方向上鍵力分布比較均勻,因此其結構無明顯解理(晶體沿某個晶面劈裂的現象稱為解理),破碎後其顆粒呈現多面體形狀。
常見的NaCI型晶體是鹼土金屬氧化物和過渡金屬的2價氧化物,化學式可寫為MO,其中M2+為2價金屬離子。結構中M2+和O2-分別占據NaCI中Na和Cl離子的位置。這些氧化物有很高的熔點,尤其是MgO(礦物名稱方鎂石),其熔點高達2800℃左右,是鹼性耐火材料鎂磚中的主要晶相。
CsCl型結構
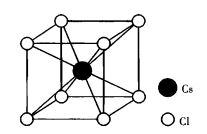 圖2 CsCl晶體結構
圖2 CsCl晶體結構CsCl屬於立方晶系,點群m3m,空間群Pm3m,如圖2所示。結構中正負離子作簡單立方堆積,配位數均為8,晶胞分子數為1,鍵性為離子鍵。CsCl晶體結構也可以看做正負離子各一套簡單立方格子沿晶胞的體對角線位移1/2體對角線長度穿插而成。
立方ZnS(閃鋅礦)型結構
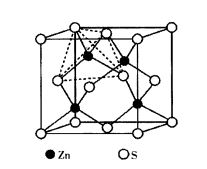 圖3立方ZnS晶體結構
圖3立方ZnS晶體結構閃鋅礦屬於立方晶系,點群-43m,空間群F-43m,其結構與金剛石結構相似,如圖3所示。結構中S2-作面心立方堆積,Zn2+交錯地填充於8個小立方體的體心,即占據四面體空隙的1/2,正負離子的配位數均為4。一個晶胞中有4個ZnS分子。整個結構由Zn2+和S2-各一套面心立方格子沿體對角線方向位移1/4體對角線長度穿插而成。由於Zn2+具有18電子構型,S2-又易於變形,因此,ZnS鍵帶有相當程度的共價鍵性質。常見閃鋅礦型結構的有Be,Cd,Hg等的硫化物、硒化物和碲化物以及CuCl及α—SiC等。
六方ZnS(纖鋅礦)型結構
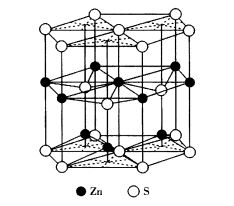 圖4 六方ZnS晶體結構
圖4 六方ZnS晶體結構纖鋅礦型結構的晶體,如ZnS、CdS、GaAs等和其他第Ⅱ與第Ⅳ族、第Ⅲ與第V族化合物,製成半導體器件,可以用來放大超音波,這樣的半導體材料具有聲電效應(通過半導體進行聲電相互轉換的現象稱為聲電效應)。
AX2型結構
AX2型結構主要有螢石(CaF2)型、金紅石(TiO2)型和方石英(SiO2)型結構。其中CaF2為雷射基質材料,在玻璃工業中常作助熔劑和晶核劑,在水泥工業中常用作礦化劑;TiO2為集成光學稜鏡材料;SiO2為光學材料和壓電材料。AX2型結構中還有一種層型的CdI2和CdCl2型結構,這種材料可作固體潤滑劑。
螢石(CaF2)型結構及反螢石型結構
螢石屬於立方晶系,點群m3m,空間群Fm3m,其結構如圖5所示。Ca2+位於立方晶胞的頂點及面心位置,形成面心立方堆積,F-填充在8個小立方體的體心。Ca2+離子的配位數是8,形成立方配位多面體[CaF8];F-離子的配位數是4,形成[FCa8]四面體,F-占據Ca2+離子堆積形成的四面體空隙的100%。該結構也可以看做F-作簡單立方堆積,Ca2+占據立方體空隙的一半,晶胞分子數為4。從空間格子方面來看,螢石結構由1套Ca2+的面心立方格子和2套F-離子的面心立方格子相互穿插而成。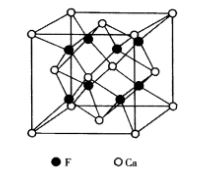 圖5 CaF2的晶體結構
圖5 CaF2的晶體結構
 圖5 CaF2的晶體結構
圖5 CaF2的晶體結構結構與性能關係方面,CaF2與NaCI的性質對比,F-半徑比Cl-小,Ca2+半徑比Na+稍大,綜合電價和半徑兩因素,螢石中質點間的鍵力比NaCI中的鍵力強。反映在性質上,螢石的硬度為莫氏4級,熔點1410℃,密度3.18 g/cm3,水中溶解度0.002;而NaCI的熔點為808 °C,密度2.16 g/cm3,水中溶解度35.7。
常見螢石型結構的晶體是一些4價離子M4+的氧化物MO2,如ThO2,CeO2,UO2,ZrO2。
鹼金屬元素的氧化物R2O、硫化物R2S、硒化物R2Se、碲化物R2Te等A2X型化合物為反螢石結構,它們的正負離子位置剛好與螢石結構中的相反,即鹼金屬離子占據F-的位置,O2-或其他負離子占據Ca2+的位置。這種正負離子位置顛倒的結構,叫做反同形體。
金紅石(TiO2)型結構
金紅石屬於四方晶系,點群4/mmm,空間群P4/mnm,其結構如圖6所示。結構中O2-作變形的六方最緊密堆積,Ti4+在晶胞頂點及體心位置,O2-在晶胞上下底面的面對角線方向各有2個,在晶胞半高的另一個面對角線方向也有2個。
Ti4+的配位數是6,形成[TiO6]八面體,O2-的配位數是3,形成[OTi3]平面三角單元。Ti4+填充八面體空隙的1/2。晶胞中TiO2的分子數為2。整個結構可以看做由2套Ti4+的簡單四方格子和4套O2-的簡單四方格子相互穿插而成。TiO2除金紅石型結構之外,還有板鈦礦和銳鈦礦兩種變體,其結構各不相同。常見金紅石結構的氧化物有SnO2,MnO2,CeO2,PbO2,VO2,NbO2等。TiO2在光學性質上具有很高的折射率(2.76),在電學性質上具有高的介電係數,因此,成為製備光學玻璃的原料,也是無線電陶瓷中需要的晶相。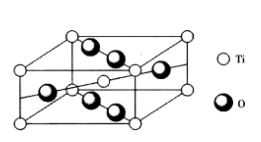 圖6 金紅石TiO2晶體結構
圖6 金紅石TiO2晶體結構
 圖6 金紅石TiO2晶體結構
圖6 金紅石TiO2晶體結構碘化鎘(CdI2)型結構
碘化鎘屬於三方晶系,空間群P3m,是具有層狀結構的晶體,如圖7所示。Cd2+位於六方柱晶胞的頂點及上下底面的中心,I-位於Cd2+三角形重心的上方或下方。每個Cd2+處在6個I-組成的八面體的中心,其中3個I-在上,3個I-在下。每個I-與3個在同一邊的Cd2+相配位。I-在結構中按變形的六方最緊密堆積排列,Cd2+相間成層地填充於1/2的八面體空隙中,形成了平行於(0001)面的層型結構。每層含有2片I-,1片Cd2+。層內[CdI6]八面體之間共面連線(共用3個頂點)。由於正負離子強烈的極化作用,層內化學鍵帶有明顯的共價鍵成分。層間通過分子間力結合。由於層內結合牢固,層間結合很弱,因而晶體具有平行(0001)面的完全解理。常見CdI2型結構的層狀晶體有Mg(OH)2和Ca(OH)2等晶體。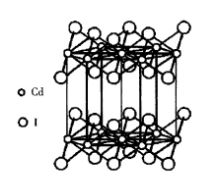 圖7 CdI2晶體結構
圖7 CdI2晶體結構
 圖7 CdI2晶體結構
圖7 CdI2晶體結構A2X3型結構
剛玉,即α一Al2O3,天然α一Al2O3單晶體稱為白寶石,其中呈紅色的稱為紅寶石,呈藍色的稱為藍寶石。剛玉屬於三方晶系,空間群R-3c。由於其單位晶胞較大且結構較複雜,因此,以原子層的排列結構和各層間的堆積順序來說明比較容易理解,見圖8。其中O2-近似地作六方最緊密堆積(HCP),Al3+填充在6個O2-形成的八面體空隙中。 圖8 剛玉的晶體結構
圖8 剛玉的晶體結構
 圖8 剛玉的晶體結構
圖8 剛玉的晶體結構剛玉型結構的化合物還有α—Fe2O3(赤鐵礦),Cr2O3,V2O3等氧化物以及鈦鐵礦型化合物FeTiO3,MgTiO3,PbTiO3,MnTiO3等。剛玉硬度非常大,為莫氏硬度9級,熔點高達2050 °C,這與Al—O鍵的牢固性有關。α一Al2O3是高絕緣無線電陶瓷和高溫耐火材料中的主要礦物。剛玉質耐火材料對PbO,B2O3含量高的玻璃具有良好的抗腐蝕性能。
AX3和A2X5型結構
AX3型晶體中有代表性的是ReO3,屬於立方晶系,正負離子配位數分別為6和2,如圖9所示。結構中[ReO6]八面體之間在三維方向共頂連線來形成晶體結構。該結構的特點是單位晶胞的中心存在很大的空隙。WO3的結構可由ReO3的結構稍加變形而得到。  圖9 ReO3晶體結構
圖9 ReO3晶體結構
 圖9 ReO3晶體結構
圖9 ReO3晶體結構A2X5型化合物的結構一般都比較複雜,其中有代表性的是V2O5,Nb2O5等。Nb2O5的結構可以由ReO3的結構演變而來。把ReO3結構中八面體的共頂連線方式換成共棱連線,即可形成Nb2O5結構。
ABO3型結構
在含有兩種正離子的多元素化合物中,其結構基元的構成分為兩類:一是結構基元是單個原子或離子;二是絡合離子。絡合離子是由數個原子或離子組成的帶電的原子或離子團,其形狀一般呈多面體。絡合離子作為一個整體可以從一個化合物中轉移到另一個化合物中,在溶液或熔體中,絡合離子也能整體存在。在絡合離子中,其中心原子與周圍配位原子間的化學鍵都具有共價鍵成分。若中心原子與配位原子之間依靠純粹的靜電力結合,則不能算作絡合離子。例如,在CaTiO3中雖存在[TiO6]八面體,但並沒有獨立的TiO32-絡離子存在。當ABO3型結構中的高價正離子B很小時,就不能被O2-以八面體形式所包圍,如C4+,Ni6+和B3+等,這時就不能形成鈣鈦礦型結構,而形成方解石或霞石型結構。
鈦鐵礦型結構
鈦鐵礦是以FeTiO3為主要成分的天然礦物,結構屬於三方晶系,其結構可以從剛玉結構衍生而來,見圖10。將剛玉結構中的2個3價陽離子用2價和4價或1價和5價兩種陽離子置換便形成鈦鐵礦結構。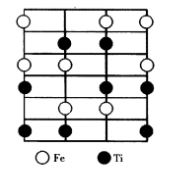 圖10 鈦鐵礦晶體結構
圖10 鈦鐵礦晶體結構
 圖10 鈦鐵礦晶體結構
圖10 鈦鐵礦晶體結構在剛玉結構中,氧離子的排列為HCP結構,其中八面體空隙的2/3被鋁離子占據,將這些鋁離子用兩種陽離子置換有兩種方式。第一種置換方式是:置換後F層和Ti層交替排列構成鈦鐵礦結構,屬於這種結構的化合物有MgTiO3,MnTiO3,FeTiO3,CoTiO3,LiTaO3等。第二種置換方式是:置換後在同一層內1價和5價離子共存,形成LiNbO3或LiSbO3結構。
鈣鈦礦型結構與鐵電效應
鈣鈦礦是以CaTiO3為主要成分的天然礦物,理想情況下其結構屬於立方晶系,如圖11所示。結構中Ca2+和O2-一起構成fcc堆積,Ca2+位於頂角,O2-位於面心,Ti4+位於體心。Ca2+,Ti4+和O2-的配位數分別為12,6和6。Ti4+占據八面體空隙的1/4。[TiO6]八面體共頂連線形成三維結構。
實際晶體中能滿足這種理想情況的非常少,多數鈣鈦礦型結構的晶體都不是理想結構,而是有一定畸變,因而產生介電性能。其中有代表性的化合物是BaTiO3和PbTiO3等,具有高溫超導特性的氧化物的基本結構也是鈣鈦礦結構。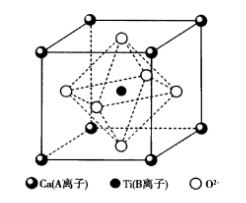 圖11 鈣鈦礦型晶體結構
圖11 鈣鈦礦型晶體結構
 圖11 鈣鈦礦型晶體結構
圖11 鈣鈦礦型晶體結構BaTiO3屬鈣鈦礦型結構,是典型的鐵電材料,在居里溫度以下表現出良好的鐵電性能,而且是一種很好的光折變材料,可用於光儲存。鐵電晶體是指具有自發極化且在外電場作用下具有電滯回線的晶體。鐵電性能的出現與晶體內的自發極化有關。晶體在外電場作用下的極化包括電子極化、離子極化和分子極化三種。
ABO4型(白鎢礦型)結構及聲光效應
白鎢礦是以PbWO4為主要成分的天然礦物,組成為ABO4。PbMoO4結構屬於白鎢礦型結構,四方晶系,如圖12所示。晶胞參數為a=0.5432 nm,b=1.2107 nm,晶胞分子數為4。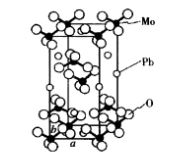 圖12 白鎢礦晶體結構
圖12 白鎢礦晶體結構
 圖12 白鎢礦晶體結構
圖12 白鎢礦晶體結構PbMoO4是一種重要的聲光材料。聲光效應是指光被聲光介質中的超音波所衍射或散射的現象。在聲光晶體的一端貼上壓電換能器(一般用LiNbO3晶體),輸入高頻電信號後壓電晶體產生高頻振盪,其頻率通常在超音波範圍內,這是一種彈性波,傳人聲光晶體後晶體將發生壓縮或伸長。當雷射束通過壓縮、伸長應變層時就能使光產生折射或衍射,折射率隨位置的周期性變化就可起到衍射光柵的作用,光柵常數就等於輸入的超音波波長。顯然,輸入的超音波波長發生變化,光衍射角也隨之變化。這樣,通過控制高頻電路的輸入頻率,就可控制雷射偏轉角。聲光雷射印表機就是利用這一原理設計而成的。
AB2O4型(尖晶石)結構
AB2O4型晶體以尖晶石為代表,其中A為2價正離子,B為3價正離子。尖晶石(MgAl2O4)結構屬於立方晶系,空間群Fd3m,如圖13所示。尖晶石晶胞可看做由8個小塊交替堆積而成。小塊中質點排列有兩種情況,分別以A塊和B塊來表示。A塊顯示出Mg2+占據四面體空隙,B塊顯示出Al3+占據八面體空隙的情況。結構中O2-作面心立方最緊密堆積,Mg2+填充在四面體空隙,Al3+占據八面體空隙。晶胞中含有8個尖晶石分子,即8個MgAl2O3,因此,晶胞中有64個四面體空隙和32個八面體空隙,其中Mg2+占據四面體空隙的1/8,Al3+占據八面體空隙的1/4。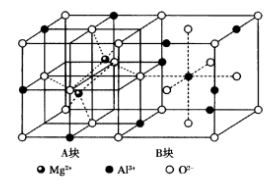 圖13尖晶石晶體結構
圖13尖晶石晶體結構
 圖13尖晶石晶體結構
圖13尖晶石晶體結構在實際尖晶石中,有的結構介於正、反尖晶石之間,即既有正尖晶石,又有反尖晶石,此尖晶石稱為混合尖晶石。例如,MgAl2O4,CoAl2O4,ZnFe2O4為正尖晶石結構;NiCo2O4,CoFe2O4等為反尖晶石結構;CuAI2O4和MgFe2O4等為混合型尖晶石。
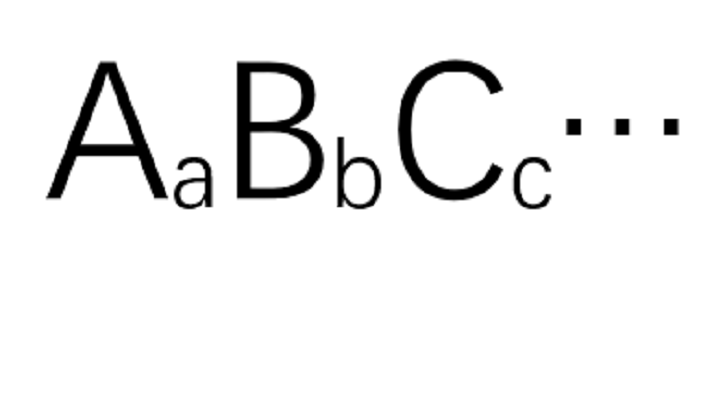
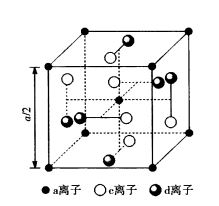 圖14石榴石結構單位簡圖
圖14石榴石結構單位簡圖