基本介紹
- 中文名:分子極化
- 外文名:molecular polarization
- 含義:分子在外電場作用下產生誘導偶極
- 套用:分子間作用力的產生
分子極性

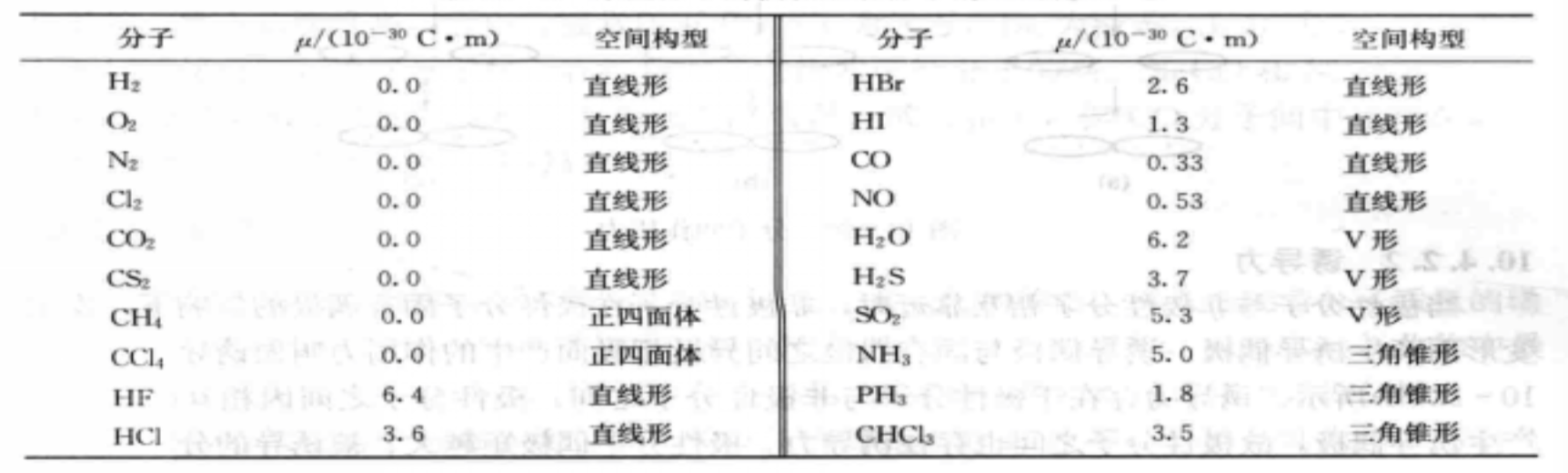 某些分子偶極矩和分子空間構型
某些分子偶極矩和分子空間構型分子的極化機理
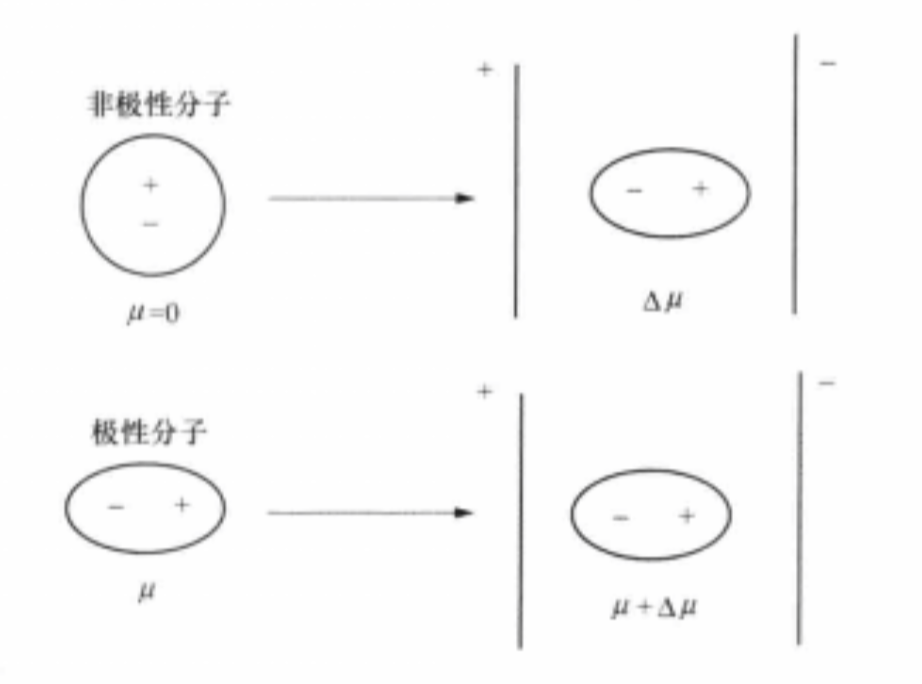 外電場對分子極性影響示意圖
外電場對分子極性影響示意圖分子極化率


 某些分子偶極矩和分子空間構型
某些分子偶極矩和分子空間構型 外電場對分子極性影響示意圖
外電場對分子極性影響示意圖
無論是非極性分子還是極性分子,在外電場作用下,分子內的正、負電荷中心都會發生相對位移,產生誘導偶極,這一過程叫作分子極化。極性分子在無外電場作用時所具有的...
極化(polarisation),指事物在一定條件下發生兩極分化,使其性質相對於原來狀態有所偏離的現象。如分子極化(偶極矩增大)、光子極化(偏振)、電極極化等。表征均勻平面波...
電介質極化是指外電場作用下,電介質顯示電性的現象。理想的絕緣介質內部沒有自由電荷,實際的電介質內部總是存在少量自由電荷,它們是造成電介質漏電的原因。 一般...
分子極化率(molecular polarizability)描述電介質極化特性的微觀參數,簡稱極化率。...... 分子極化率(molecular polarizability)描述電介質極化特性的微觀參數,簡稱極化率...
離子極化理論是離子鍵理論的重要補充。離子極化理論認為:離子化合物中除了起主要作用的靜電引力之外,誘導力起著很重要的作用。離子本身帶電荷,陰、陽離子接近時,在...
極化技術,簡單來說是一種具有誘導各物質的分子間的作用力,產生強力的極化能力的技術,影響其原本的物理性質,改變其比如溶沸點。例如在能源行業,極化技術可以使油品...
絕大多數高聚物是優良的電絕緣體,有高的電阻率,低介電損耗、高的耐高頻性和高的擊穿強度。因此在電場的作用下很容易產生極化。...
分子電極化率是指單位電場強度下的平均誘導電偶極矩p,單位是C·m2/V。無論是極性分子或非極性分子,在電場強度正作用下都會產生與電場方向相反的誘導電偶極矩pI,...
電子極化是指在外加電場的影響下,由於電子對它相關原子核的位移所引起的極化。...... 一般把這種現象稱為原子或分子極化。上圖表示了在外施電場作用下電介質中的...
一些本身不易得失電子的中性原子或分子相互結合時,其內部的電子可能發生不均勻的重新分布,這種電簡不均勻性使其一端呈現負電性,另一商呈現正電性,這種現象稱為...
在外電場作用下,構成電介質的分子、原子或離子中的外圍電子云相對原子核發生彈性位移而產生感應偶極矩的現象,稱為電子位移極化,簡稱位移極化。...
離子使異號離子極化而變形的作用稱為該離子的“極化作用”;被異號離子極化而發生離子電子云變形的性能稱為該離子的“變形性”。...
鍵的極化性是共價鍵在外電場的作用下,使鍵的極性發生變化。鍵的極化性用鍵的極化度來度量,其大小除與成鍵原子的體積、電負性和鍵的種類有關外,還與外電場強度...
電場矢量在空間的取向固定不變的電磁波叫線極化。有時以地面為參數,電場矢量方向與地面平行的叫水平極化,與地面垂直的叫垂直極化。電場矢量與傳播方向構成的平面叫...
偶極子極化是指在電場作用下,組成介質的分子的固有偶極矩將沿著電場方向排列,所有偶極矩的矢量和不為零,介質產生巨觀極化強度。...
濃差極化是指分離過程中,料液中的溶液在壓力驅動下透過膜,溶質(離子或不同分子量溶質)被截留,在膜與本體溶液界面或臨近膜界面區域濃度越來越高;在濃度梯度作用下...
表示電極電位與極化電流或極化電流密度之間的關係曲線。如電極分別是陽極或陰極,所得曲線分別稱之為陽極極化曲線(anodic polarization curve)或陰極極化曲線(cathodic ...
電極化強度是指電介質極化程度和極化方向的物理量,是一個無量綱的純數,電極化強度P定義為單位體積內分子電偶極矩p的矢量和。...
