根據現代無機化學的定義:凡是能給出質子的物質都是酸,凡是能與質子結合的物質都是鹼,酸與鹼之間的這種關係稱為酸鹼共軛關係,相對應的酸鹼稱為共軛酸鹼。
基本介紹
- 中文名:共軛酸鹼
- 外文名:conjugate acid-base pair
- 屬性:化合物
- 學科:化學
概念
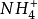

共軛鹼一般指本詞條
根據現代無機化學的定義:凡是能給出質子的物質都是酸,凡是能與質子結合的物質都是鹼,酸與鹼之間的這種關係稱為酸鹼共軛關係,相對應的酸鹼稱為共軛酸鹼。
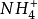
根據現代無機化學的定義:凡是能給出質子的物質都是酸,凡是能與質子結合的物質都是鹼,酸與鹼之間的這種關係稱為酸鹼共軛關係,相對應的酸鹼稱為共軛酸鹼。...
質子理論闡述,能給出質子的分子或離子是酸,能接受質子的分子或離子是鹼,酸給出質子轉變為相應的鹼,鹼接受質子轉變為相應的酸,這種因質子得失而相互轉變的一對...
酸放出質子後形成的鹼,叫做該酸的共軛鹼;鹼接受質子後形成的酸,叫做該鹼的共軛酸。我們把相差一個質子的對應酸鹼,叫做共軛酸鹼對。中文...
雙分子共軛鹼消除:即E2反應,反應體系中若有鹼存在,則隨著鹼濃度的提高,消除產物增多。這說明反應速度不僅與鹵代烷的濃度有關,而且還與鹼的濃度有關,在動力學上...
根據酸鹼的質子理論,容易放出質子(H+)的物質是強酸,而該物質放出質子後就不容易形成鹼,同質子結合能力弱,因而是弱的鹼。換言之,酸越強,它的共軛鹼就越弱;...
上式中的酸鹼稱為共軛酸鹼對,鹼是酸的共軛鹼,酸是鹼的共軛酸[1] ,這個式子表明,酸和鹼是相互依賴的。同時,易證得:在水溶液中, ,因此,共軛酸的酸性越強,...
酸鹼電離理論由阿倫尼烏斯提出,在水溶液中電離出的陽離子全部是氫離子的化合物...凡是能給出質子的物質都是酸,凡是能接受質子的都是鹼。酸鹼共軛關係:酸=鹼+...
酸鹼質子理論認為,在化學反應過程中,凡是能給出質子(H+)的物質都是酸,凡是能接受質子的物質都是鹼。酸鹼反應實際上是酸、鹼之間的質子傳遞反應,其反應方向總是...
酸鹼質子理論認為,酸、鹼的強度是指酸給出質子的能力和鹼接受質子的能力。酸、鹼的強弱首先取決於其本身給出或接受質子的能力,其次取決於溶劑接受或給出質子的...
因此,一種酸釋放質子後即成為鹼,稱為該酸的共軛鹼;同樣一種鹼與質子結合後,形成對應的酸,稱為該鹼的共軛酸。當一個分子或離子釋放氫離子,同時一定有另一個...
水合氫離子的濃度取決於弱酸與其共軛鹼的濃度比。當加入少量強鹼時,酸被中和,導致了氫氧根離子在溶液中很少累積,從而 的濃度增加, 的濃度減少。可以看到,雖然加入...
但是與E1反應相比,此類反應中發生消除的不是底物分子,而是底物的共軛鹼,因此記為“E1cB反應”,全稱“單分子共軛鹼消除反應”。具有以下特點的物質容易發生E1cB反應:...
在水溶液中由於酸及其共軛鹼的電離作用就等同於水的自我離子化,酸度係數與鹼度係數(pKb)的和就相等於水的離解常數(pKw),在25℃下pKa+pKb=pKw=14 [4] 。...
共軛鹼單分子消除反應(E1CB) 反應物先與鹼作用,失去β氫原子,生成反應物的共軛鹼碳負離子,然後從這個碳負離子失去離去基團並生成π鍵。在生成π鍵的步驟中只有...
Brönsted酸鹼理論認為,能放出質子的物質為酸,放出質子後的物質為該酸的共軛鹼;能接受質子的物質為鹼,接受質子後的物質為該鹼的共軛酸。Brönsted酸性強度實際...
3.化學計量點時(Va=Vb) 此時為NaAc溶液,其酸度由HAc的共軛鹼Ac-的Kb和Cb決定,由於溶液的體積增大1倍,故Cb=0.0500mol/L,則 3 :4.化學計量點後(Va<Vb)...
霍夫曼反應按“接近E1cb的E2”的機理進行(見消除反應),但過程中並不生成共軛鹼負碳離子。...
亨德森-哈塞爾巴爾赫方程(Henderson-Hasselbalch equation)是化學中關於酸鹼平衡的一...體系中,只要弱酸及其共軛鹼的濃度相等,pH即確定為pKa,而與濃度無關。 緩衝體系...
