共價鍵的共用電子對由成鍵的兩個原子各提供一個電子組成的, 稱為正常共價鍵。此外,還有一類共價鍵,其共用電子對完全是由一個成鍵原子單獨提供的。這種由一個原子單獨提供共用電子對而形成的共價鍵稱為配位共價鍵,簡稱配位鍵。
基本介紹
- 中文名:配位共價鍵
- 外文名:coordinate-covalent bond
- 屬性:化學鍵
- 所屬學科:化學
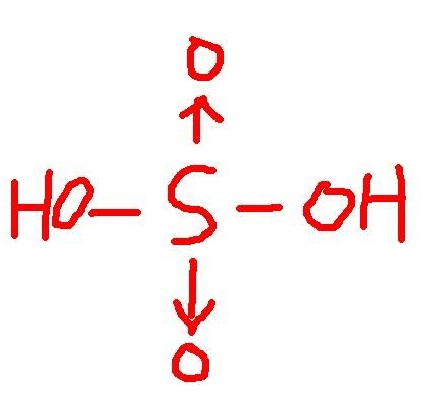
共價鍵的共用電子對由成鍵的兩個原子各提供一個電子組成的, 稱為正常共價鍵。此外,還有一類共價鍵,其共用電子對完全是由一個成鍵原子單獨提供的。這種由一個原子單獨提供共用電子對而形成的共價鍵稱為配位共價鍵,簡稱配位鍵。
共價鍵的共用電子對由成鍵的兩個原子各提供一個電子組成的, 稱為正常共價鍵。此外,還有一類共價鍵,其共用電子對完全是由一個成鍵原子單獨提供的。這種由一個...
共價鍵(covalent bond),是化學鍵的一種,兩個或多個原子共同使用它們的外層電子,在理想情況下達到電子飽和的狀態,由此組成比較穩定的化學結構叫做共價鍵,或者說共價...
配位鍵,又稱配位共價鍵,或簡稱配鍵,是一種特殊的共價鍵。當共價鍵中共用的電子對是由其中一原子獨自供應,另一原子提供空軌道時,就形成配位鍵。配位鍵形成後...
共價鍵結合是原子以有機化合物分子基本的、共同的結構特徵,在有機化合物分子中,主要的、典型的化學鍵是共價鍵。所以,了解和熟悉共價鍵,是研究和掌握有機化合物的...
為一類具有特徵化學結構的化合物,由中心原子(或離子,統稱中心原子)和圍繞它的分子或離子(稱為配位體/配體)完全或部分通過配位鍵結合而形成。包含由中心原子或離子...
配位物為一類具有特徵化學結構的化合物,由中心原子或離子(統稱中心原子)和圍繞它的稱為配位體(簡稱配體)的分子或離子,完全或部分由配位鍵結合形成。包含由中心...
一種共價鍵。成鍵的兩原子間共享的兩個電子不是由兩原子各提供一個,而是來自一個原子。...
很多配合物的中心原子與配體(例如CN-、NO、SCN-、Br-、I-、NH3和CO等)間主要形成共價鍵,它們的配位數決定於中心原子成鍵軌道的性質。...
隨後,1916年Lewis的共價鍵理論,1923年Sidgwick的有效原子序數法則、1929年Bethe的晶體場理論、1935年VanVleck的配位場理論、1939年Pauling的價鍵理論、1951年Pauson和...
配位數 數至少為15。此概念也可延伸至任何化合物,也就是配位數等同於共價鍵鍵連數,例如,可以說甲烷中碳的配位數為4。這種說法通常不計π鍵。晶體學中,配位...
配位基在錯化合物中通常以中性金屬原子或陽離子為中心原子,中心原子可與具有未共用電子對之陰離子或分子(稱為配位基)結合形成配位鍵。若配位基只能提供一對未...
配位化學是研究金屬的原子或離子與無機、有機的離子或分子相互反應形成配位化合物的特點以及它們的成鍵、結構、反應、分類和製備的學科。...
其特點是:(1)配體的配位原子有明確的孤對電子,可以給予中心原了形成配位共價鍵(2;中心原子具有正常氧化數。它們通常可在含中心原子(或離子)的鹽中加人過量的...
只含共價鍵的化合物,叫做共價化合物。部分氫化物、酸、非金屬氧化物和大多數有機化合物,都屬於共價化合物,共價化合物中可能含有金屬元素,如三氯化鋁,完全由非金屬...
(2) 按共用電子對是否偏移分類,有極性鍵(H—Cl)和非極性鍵(Cl—Cl)。(3) 按提供電子對的方式分類,有正常的共價鍵和配位鍵(共用電子對由一方提供,另一方...
原子通過共用電子對而形成的化學鍵叫電子對鍵,又叫共價鍵(covalent bonding)。兩原子間共用一對電子的共價鍵叫共價單鍵(single covalent bonding),共用兩對、三對...
