價層電子對互斥模型是將共用電子對與孤對電子的概念,與原子軌道的概念相結合,且電子斥力達到最小。在這個模型中電子對相互排斥,成鍵電子與孤對電子距離越遠越好。VSEPR模型以最簡單的方法形象化了化學變化,也很容易判斷物質的空間構型。
基本介紹
- 中文名:價層電子對互斥模型
- 外文名:Valence Shell Electron Pair Repulsion Theory
- 詞條:價層電子對互斥模型
- 簡稱:VSEPR模型
基本信息
簡介
AXE方法
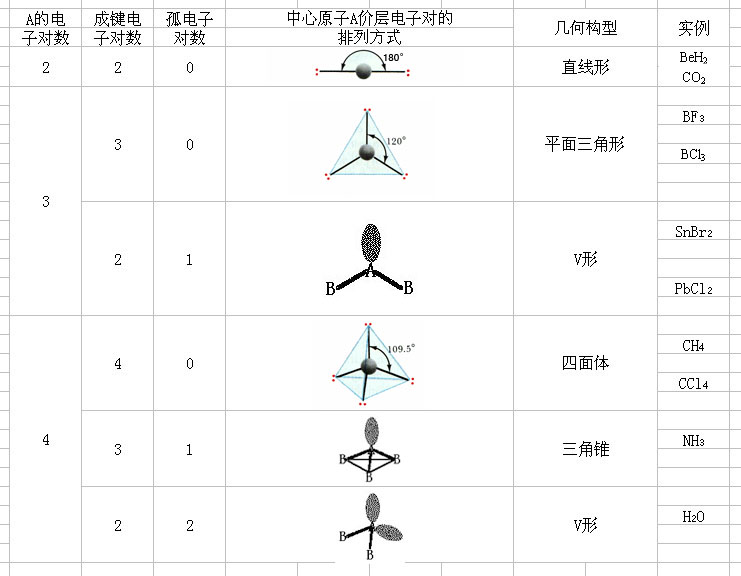 常見分子的構型
常見分子的構型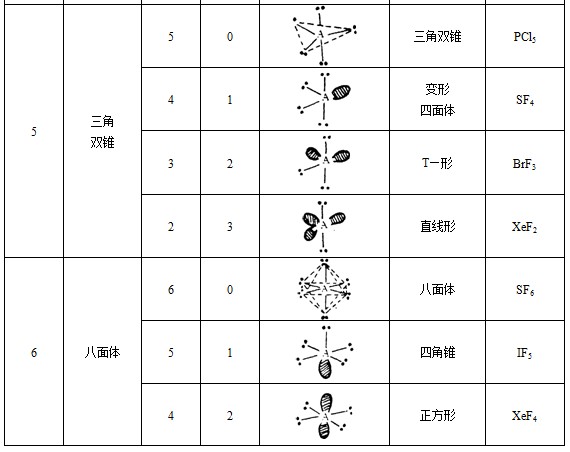
價層電子對互斥模型是將共用電子對與孤對電子的概念,與原子軌道的概念相結合,且電子斥力達到最小。在這個模型中電子對相互排斥,成鍵電子與孤對電子距離越遠越好。VSEPR模型以最簡單的方法形象化了化學變化,也很容易判斷物質的空間構型。
 常見分子的構型
常見分子的構型價層電子對互斥理論(英文:Valence Shell Electron Pair Repulsion,簡稱為VSEPR),是一個用來預測單個共價分子形態的化學模型。理論通過計算中心原子的價層電子數和配位...
價層電子對互斥模型是將共用電子對與孤對電子的概念,與原子軌道的概念相結合,且電子斥力達到最小。在這個模型中電子對相互排斥,成鍵電子與孤對電子距離越遠越好。...
價電子對互斥理論(Valence Shell Electron Pair Repulsion (VSEPR)),是一個用來預測單個共價分子形態的化學模型。理論通過計算中心原子的價層電子數和配位數來預測...
電子對互斥理論(electron-pair repulsion theory),又稱價層電子對互斥理論。...... 電子對互斥理論(electron-pair repulsion theory),又稱價層電子對互斥理論。...
1 電子對生成 2 價層電子對互斥理論 3 電子對效應 電子對電子對生成 編輯 y光子從原子核近旁經過時,在原子核的庫侖場作用下,y光子轉化為一個正電子和一個...
1940年 Sidgwick 提出價層電子對互斥理論,用以判斷分子的幾何構型. 分子 ABn 中,A 為中心,B 為配體,B均與A有鍵聯關係. 本節討論的 ABn 型分子中,A為主族...
球麵點電荷模型是學習價層電子對互斥理論的基礎。當球面上有若干個點電荷時,它們在球面上分布必須相互保持最大距離使得排斥最小。 當有兩個點電荷時,它們分布在球...
這種理論模型後經羅納德·吉列斯比(R.J.Gillespie)和羅納德·尼霍爾姆(R.S.Nyholm)在20世紀50年代加以發展,定名為價層電子對互斥理論,簡稱VSEPR。VSEPR與軌道...
分子的幾何構型價層電子對互斥理論(VSEPR理論) 該理論對解釋許多非共扼多原子分子的幾何構型很有幫助,而且非常簡單易行。在AXm型分子或基團中,假如中心原子A的價...
1 雜化軌道與分子構型 ▪ sp雜化 ▪ sp2雜化 ▪ sp3雜化 2 價層電子對互斥理論 3 預測分子空間構型步驟 分子空間構型雜化軌道與分子構型 編輯 分子...
共價化合物價層電子對互斥理論 編輯 價鍵理論和雜化軌道理論都可以解釋共價鍵的方向性,尤其是雜化軌道理論成功地解釋了部分共價分子雜化與空間構型的關係,但是有些...
13.3 軌道雜化理論 13.3.1 軌道雜化理論的基本要點 13.3.2 雜化類型 13.4 價層電子對互斥理論 13.4.1 價層電子對互斥理論的基本要點 ... 第14章 晶體...
12.3價鍵理論12.4分子軌道理論12.5價層電子對互斥理論12.6分子的極性12.7金屬鍵理論12.8分子間作用力和氫鍵第13章晶體與晶體結構13.1晶體的特徵...
8.2.1 價鍵理論 8.2.2 雜化軌道理論 8.2.3 價層電子對互斥理論 8.2.4 分子軌道理論 8.2.5 離域大π鍵 8.3 金屬鍵理論 8.3.1 金屬鍵的改性共價鍵...
理論49三、價層電子對互斥理論53四、分子軌道理論56五、原子晶體(共價晶體)60第三節分子間力、氫鍵和分子晶體60一、分子的極性和分子的極化61二、分子間作用力62...
9.2.2現代價鍵理論9.3雜化軌道理論9.3.1雜化軌道理論基本要點9.3.2雜化軌道類型9.4價層電子對互斥理論9.4.1價層電子對互斥理論基本要點...
2.1.1 價鍵理論2.1.2 雜化軌道理論2.1.3 分子軌道理論2.1.4 價層電子對互斥理論2.1.5 分子間作用力2.1.6 氫鍵2.2 歷年考研試題精選...
2.3 共價鍵的價鍵理論2.4 雜化軌道理論2.5 價層電子對互斥理論2.6 分子軌道理論2.7 共價鍵的極性和分子的極性2.8 金屬鍵理論2.9 分子間力和氫鍵2.10 離子的...
這種理論模型後經羅納德·吉列斯比(R.J.Gillespie)和羅納德·尼霍爾姆(R.S.Nyholm)在20世紀50年代加以發展,定名為價層電子對互斥理論,簡稱VSEPR。VSEPR與軌道...
13.3軌道雜化理論 13.3.1軌道雜化理論的基本要點 13.3.2雜化類型 13.4價層電子對互斥理論 13.4.1價層電子對互斥理論的基本要點 13.4.2分子結構的...
第二節 雜化軌道理論第三節 價層電子對互斥理論第四節 分子軌道理論簡介第五節 分子間作用力思考題和練習題第十二章 配位化合物第一節 配位化合物的基本概念...
本課程包括四個部分:第一部分主要介紹化學熱力學基礎知識和化學基本原理;第二部分主要介紹原子結構、化學鍵(價鍵理論、雜化軌道理論、價層電子對互斥理論)和分子間...
▪ 甲基橙 ▪ 價層電子對互斥理論 ▪ 價鍵理論 ▪ 價鍵理論 ▪ 檢測系統 ▪ 鹼金屬 ▪ 鹼土金屬 ▪ 鍵長 ▪ 鍵級 ▪ 鍵角 ▪ 鍵...
2 2雜化軌道理論與分子的幾何構型472 2 1sp雜化482 2 2sp2雜化492 2 3sp3雜化492 2 4不等性雜化49*2 3價層電子對互斥理論51...
第三節 價層電子對互斥理論第四節 分子軌道理論第五節 分子間作用力和氫鍵習題第四章 化學熱力學第一節 熱力學的一些基本術語第二節 勢力學的第一定律概述...
