正常人血紅蛋白分子含二價鐵(Fe2+),與氧結合為氧合血紅蛋白。當血紅蛋白中鐵喪失一個電子,被氧化為三價鐵(Fe3+)時,即稱為高鐵血紅蛋白(簡稱MetHb)。正常人血MetHb僅占血紅蛋白總量的1%左右,並且較為恆定。當血中MetHb量超過1%時,稱為高鐵血紅蛋白血症(methemoglobinemia)。
中毒性高鐵血紅蛋白血症
相關詞條
- 中毒性高鐵血紅蛋白血症
中毒性高鐵血紅蛋白血症編輯 鎖定 正常人血紅蛋白分子含二價鐵(Fe2+),與氧結合為氧合血紅蛋白。當血紅蛋白中鐵喪失一個電子,被氧化為三價鐵(Fe3+)時,即稱為...
- 高鐵血紅蛋白血症
高鐵血紅蛋白血症治療原則 1.先天性MHb血症不需治療。核黃素和大量維生素C可以減低MHb含量。2.中毒性MHb血症,症狀明顯,MHb含量超過20%者,應及時處理,...
- 高鐵血紅蛋白
高鐵血紅蛋白臨床意義 增高見於:(1)先天性高鐵血紅蛋白血症。(2)中毒性高鐵血紅蛋白血症(獲得性症狀),一般有服用某些藥物的病史。...
- 正鐵血紅蛋白血症
正鐵血紅蛋白血症(Methemoglobinemia),或高鐵血紅蛋白症、變性血色蛋白血症,是指因血液中異常的出現過多不能帶氧的正鐵血紅蛋白導致身體出現缺氧變藍症狀。若血液...
- 高鐵血紅蛋白定量檢測
高鐵血紅蛋白定量測定可用於診斷高鐵血紅蛋白症。高鐵血紅蛋白的含量增高見於:①先天性高鐵血紅蛋白血症。②中毒性高鐵血紅蛋白血症(獲得性症狀),一般有服用某些藥物的...
- 中毒性溶血性貧血
中毒性溶血性貧血是指化學毒物導致紅細胞破壞增加,超過骨髓補償能力而產生的貧血。氧化性毒物可使血紅蛋白氧化成高鐵血紅蛋白,產生赫恩小體導致溶血(參見中毒性高鐵...
- 假正鐵血紅蛋白
假正鐵血紅蛋白是主要是測定血漿中高鐵血紅蛋白的含量,用於診斷高鐵血紅蛋白血症的化學物質。...
- 強酸類中毒
硝酸中毒除上述症狀外,還可導致高鐵血紅蛋白血症,並出現血壓下降和心肌損害等;小兒因誤服草酸和草酸鹽中毒時,可引起低血鈣及手足搐搦。若腎小管被草酸鈣等結晶體...
- 三硝基甲苯中毒
三硝基甲苯中毒是接觸過量三硝基甲苯(TNT)引起的主要損害晶狀體、肝和血液系統的疾病。急性中毒出現高鐵血紅蛋白血症、紫紺及中樞神經系統抑制。慢性中毒除神經衰弱綜合...
- 急性中毒
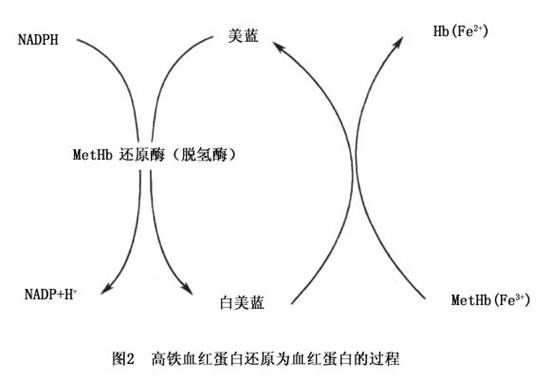
(2)高鐵血紅蛋白血症解毒藥:亞甲藍(美藍):用於治療亞硝酸鹽、苯胺、硝基苯等中毒引起的高鐵紅蛋白血症。方法:用1%亞甲藍5--10ml(1--2mg/kg)靜脈注射,如...
- 苯胺中毒
苯胺中毒是苯胺進入人體所致疾病,中毒早期表現為紫紺,重症時神志恍惚,步態蹣跚,...在體內的代謝物,具有氧化血紅蛋白為高鐵血紅蛋白的能力,引起高鐵血紅蛋白血症,...
- 鉍中毒
服用大量次硝酸鉍,可出現亞硝酸鹽中毒的症狀,如頭昏、脈速、胸部壓迫感、呼吸困難,以及由於高鐵血紅蛋白血症引起的口唇、甲床發紺;重症者出現低血壓、休克等。當...
- 乙醯苯胺類中毒
中毒病兒除有噁心,嘔吐,耳鳴,出汗等外,主要表現為高鐵血紅蛋白血症所致的紫紺,並伴有呼吸急促,心率增快等缺氧症狀;同時可發生溶血性貧血,出現血紅蛋白尿,尿由鮮明...
- 酚類中毒
較大面積皮膚污染時,可經皮吸收引起中毒。表現為心律失常(室上性或室性)、休克、代謝性酸中毒等。尚有通氣過度、腎損害和高鐵血紅蛋白血症的報導。 吸入高濃度...
- 氮氧化物中毒
急性中毒,中毒初期僅有輕微的眼和上呼吸道症狀,脫離中毒現場後,症狀很快消失而常不被注意。經過4~6h或更長的潛伏期後,出現肺水腫和高鐵血紅蛋白血症。氮氧化物...
- 二氧化氮中毒
二氧化氮中毒病因 NO2為刺激性氣體,對上呼吸道黏膜刺激作用弱,主要進入下呼吸道...4.治療高鐵血紅蛋白血症。 5.對症與支持處理 補充適當容量、或加用血管活性藥物...
- 實用急性中毒全書
第二節有機磷酸酯類中毒解毒藥第三節高鐵血紅蛋白血症和氰化物中毒解毒藥第四節其他解毒藥第五十章外用藥物第五篇中草藥第五十一章 中藥不良反應概述...
- 急性苯胺中毒
疾病名稱急性苯胺中毒疾病概述急性苯胺中毒是常見的職業中毒之一。中毒早期常致中毒性高鐵血紅蛋白血症,重者在中毒後可發生急性溶血性貧血。疾病分類急診科 疾病描述...
- 發紺
(二)異常血紅蛋白血症1.高鐵血紅蛋白血症:可由伯氨喹啉、亞硝酸鹽、磺胺類、硝基苯、苯胺等藥物或化學物質中毒所致;也可因大量進食含有亞硝酸鹽的變質蔬菜引起...
- 苯丙碸
8.用藥過程中如出現新的或中毒性皮膚發應,應迅速停用本品。但出現麻風反應狀態...過量服用本品主要導致高鐵血紅蛋白血症、溶血、肝腎功能損害和精神障礙。逾量 ...
- 血液型缺氧
原因:1.貧血,2.一氧化碳中毒,3.高鐵血紅蛋白血症詞條標籤: 疾病症狀 , 生物化學 , 學科, 醫學術語 V百科往期回顧 詞條統計 瀏覽次數:次 編輯次數:6次歷史...
- 腸源性發紺
若因進食導致大量血紅蛋白氧化而引起的高鐵血紅蛋白血症稱為腸源性青紫或腸源性發紺。 進食亞硝酸鹽或富含其成分的蔬菜、井水所致,亞硝酸鹽可使正常血紅蛋白氧化成...
