腺苷脫氨酶(Adenosine deaminase)是一種參與嘌呤代謝作用的酶。它是用作拆解食物組織中的核酸中的腺苷。在人體中,它主要參與了免疫細胞的製造;若該酶突變,會造成T細胞、B細胞、自然殺手細胞皆無法表現的嚴重複合型免疫缺乏症(SCID)
基本介紹
- 中文名:ada
- 外文名:EC:3.5.4.4 adenosine deaminase ADA
- 定義:腺苷脫氨酶
- 分布:人體組織中
簡介
結構
反應
催化機理
功能
病理學
異構體
臨床意義
腺苷脫氨酶(Adenosine deaminase)是一種參與嘌呤代謝作用的酶。它是用作拆解食物組織中的核酸中的腺苷。在人體中,它主要參與了免疫細胞的製造;若該酶突變,會造成T細胞、B細胞、自然殺手細胞皆無法表現的嚴重複合型免疫缺乏症(SCID)

Ada,是一種程式設計語言。源於美國軍方的一個計畫,旨在整合美軍事系統中運行著上百種不同的程式設計語言。其命名是為了紀念世界上第一位程式設計師Ada Lovelace。Ada...
腺苷脫氨酶(EC:3.5.4.4 adenosine deaminase ADA)是嘌呤核苷代謝中重要的酶類,屬於巰基酶,每分子至少含2個活性巰基,其活性能對氯汞甲酸完全抑制。ADA能催化腺...
Ada是一個通用的歐洲國家女性名稱,通常譯為“艾達”,從含義上有 (老式英語)"高貴"的意思,為Adelaide的簡寫。Ada給人的印象是年長保守,辛勤的工作者。...
ADA作為一個首字母縮略詞,可以指化學物質偶氮甲醯胺,也可以指分子生物學中的腺苷脫氨酶。非縮略詞的Ada是個通用的歐洲國家女性名字,通常譯為“艾達”,電腦程式...
Ada是一種表現能力很強的通用程式設計語言,它是美國國防部為克服軟體開發危機,耗費巨資,歷時近20年研製成功的。它被譽為第四代計算機語言的成功代表。與其他流行的...
美國糖尿病學會(ADA)以預防和護理糖尿病並改善所有被糖尿病困擾的病人生活為宗旨,並在美國跨地區的社區中提供各種服務。...
Adaboost是一種疊代算法,其核心思想是針對同一個訓練集訓練不同的分類器(弱分類器),然後把這些弱分類器集合起來,構成一個更強的最終分類器(強分類器)。...
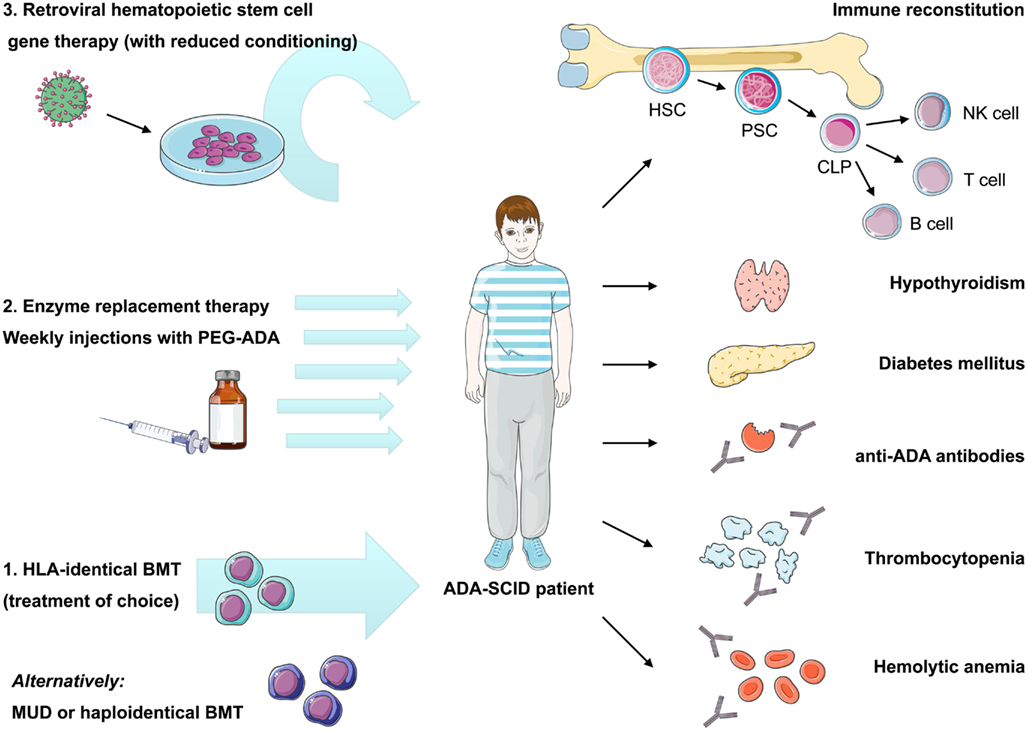
ADA缺乏症是由於腺苷酸脫氨酶(ADA)缺乏,而導致脫氨腺苷酸增多,改變了甲基化能力,產生毒性效應,使T細胞受損,機體可出現反覆感染等症狀。該病以往主要是依靠骨髓...
Ada語言是1979年由美國國防部歷時8年,耗資5億美元研製成功的一種商標準程式設計語言。原稱DOD一1語言,是在“Green”語言基礎上發展起來的。...
是指ADA水族專用底泥。ADA水族是日本知名水族館,擁有獨立生產能力,提供全套水族用品,由於品質上乘所以廣受水族愛好者喜愛,ADA水族專用低泥就是一個精品,主要分為黑...
Ada是英國作家J.R.R.托爾金為他的小說《魔戒》所創造的精靈族辛達林語(Sindarin)中的一個詞,意為“父親”。...
Ada95Ada95語言是在Ada83基礎上修訂而成的,它幾乎提供了現代程式設計范型及程式設計實踐所需要的一切設施,它可以支持面向對象的程式設計、大型程式設計、實時與並行...
Brugada綜合徵診斷標準:無論是否套用鈉通道阻斷劑,>1個右胸導聯(V1~V3)出現1型ST段抬高,並且伴以下情況之一:①記錄到的室性心律失常(記錄到心室顫動、自行終...
ada是日本知名水族館。擁有獨立水族產品的生產能力。...... ADA 水族是日本知名水族館。 ada產品 編輯 擁有獨立水族產品的生產能力,提供全套水族用品,由於品質上乘...
ada(美國殘疾人法案)編輯 鎖定 本詞條缺少信息欄、名片圖,補充相關內容使詞條更完整,還能快速升級,趕緊來編輯吧!美國殘疾人法案(英語:Americans with Disabilities...
Ada Pometti參與了《La cameriera seduce i villeggianti》、《野蠻三人組》等影視作品,擔任職務是演員。...
學過程式開發的人可能聽說過ada語言,她是美國國防部開發的面向對象的高級程式語言,取名ada是為了紀念世界上第一位程式設計師--詩人拜倫的女兒。 GNU Ada是少有的...
ADA4004-4是一款1.8 nV/√Hz精密四通道放大器,採用16引腳4 mm × 4 mm LFCSP封裝,具有40 μV的失調電壓,0.7 μV/°C的漂移,12 MHz頻寬,每通道放大器的...
北京建築大學建築設計藝術(ADA)研究中心,成立於2013年9月。是一個針對建築、設計、藝術及其相關領域的先鋒理論與現代實踐進行整體研究的綜合性研究機構。ADA研究中心...
艾達·王(Ada Wong)是卡普空開發的恐怖冒險類遊戲《生化危機》系列中的角色,她是一位十分神秘的華人女性,背景不明,雖與大反派威斯克有合作,但只是互相利用的關係...
奧古斯塔·阿達·金,勒芙蕾絲伯爵夫人(Augusta Ada King, Countess of Lovelace,1815年12月10日-1852年11月27日),原名奧古斯塔·阿達·拜倫(Augusta Ada Byron),...
腺苷脫氨酶(EC:3.5.4.4 adenosine deaminase ADA)是嘌呤核苷代謝中重要的酶類,屬於巰基酶,每分子至少含2個活性巰基,其活性能對氯汞甲酸完全抑制。ADA能催化腺...
ADA,中文稱為艾達幣,其名稱來源於16世紀的義大利數學家Gerolamo Cardano。Cardano既是醫生,也是占星術士、哲學家同時也是個賭徒。他運用占星術預言自己的死期,據說最後...
莊心妍(Ada),1993年1月9日出生於廣東省陸豐市,華語流行音樂女歌手。2012年,因發行首支單曲《一萬個捨不得》,從而正式出道。2013年,獲得酷狗繁星網新聲代歌唱比賽...
艾達·泰,法國女演員,代表作為《大魚》。Ada Tai和她的雙胞胎姐妹Arlene Tai在《大魚》一片中分別飾演連體雙胞胎歌手Ping和Jing。...
