基本介紹
介紹

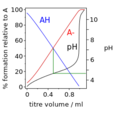

緩衝溶液指的是由弱酸及其鹽、弱鹼及其鹽組成的混合溶液,能在一定程度上抵消、減輕外加強酸或強鹼對溶液酸鹼度的影響,從而保持溶液的pH值相對穩定。
正常人血漿的pH值為7.35~7.40。血漿PH值的相對恆定性有賴於血液內的緩衝物質以及正常的肺、腎功能。血漿的緩衝物質包括NaHCO3/H2CO3、蛋白質鈉鹽/蛋白質和...
當往某些溶液中加入一定量的酸和鹼時,有阻礙溶液pH變化的作用,稱為緩衝作用,這樣的溶液叫做緩衝溶液。弱酸及其鹽的混合溶液(如HOAc與NaOAc),弱鹼及其鹽的混合溶液...
PBS是磷酸緩衝鹽溶液(phosphate buffer saline)一般作為溶劑,起溶解保護試劑的作用。它是生物化學研究中使用最為廣泛的一種緩衝液,主要成分為Na2HPO4、KH2PO4、...
磷酸緩衝液(PB,Phosphate Buffer),是生物化學研究中使用最為廣泛的一種緩衝液,通常使用的有磷酸鈉緩衝液(NaH2PO4&Na2HPO4)和磷酸鉀緩衝液(K2HPO4&KH2PO4)...
磷酸鹽緩衝液(Phosphate Buffered Saline,簡稱PBS)是常用的用於生物學研究的一個緩衝溶液。...
測定pH 值時,應嚴格按儀器的使用說明書操作,並注意下列事項。(1)測定前,按各品種項下的規定,選擇兩種pH 值約相差3 個pH 單位的標準緩衝液,並使供試液的pH ...
PBS溶液又稱磷酸鹽緩衝溶液,一般選擇Na2HPO4和KH2PO4配製,因為鈉鹽溶解的較慢。根據不同pH的溶液,稱量不同質量的磷酸鹽,也可以用pH計調溶液的pH。PBS一般用作...
TAE緩衝液是由三羥甲基氨基甲烷(Tris base)、乙酸(acetic acid)和乙二胺四乙酸(EDTA)組成的緩衝液,英文名為三種組成成分的首字母。在分子生物學實驗中常被用作...
醋酸鹽緩衝液(pH3.5)取醋酸銨25g,加水25ml溶解後,加7mol/L鹽酸溶液38ml,用2mol/L鹽酸溶液或5mol/L氨溶液準確調節PH值至3.5(電位滴定法),用水稀釋至100ml,...
緩衝溶液(Buffer Solution)是一種能在加入少量酸或鹼和水時大大減低pH變動的溶液。...... 緩衝溶液(Buffer Solution)是一種能在加入少量酸或鹼和水時大大減低pH...
檸檬酸鹽緩衝液主要成分為檸檬酸和磷酸氫鈉,常用於免疫分析。...... 檸檬酸鹽緩衝液在醫學辭彙中還縮寫為CPBS,PH=5.5,常用於免疫分析,如ELISA法,主要成分為檸檬...
23.對弱緩衝液(如純化水或注射用水)的pH值測定,先用鄰苯二甲酸氫鉀標準緩衝液校正儀器後測定供試液,並重取供試液再測,直至pH值的讀數在1分鐘內改變不超過±...
血漿的pH決定於碳酸氫鹽與碳酸的比例,而不是決定於它們的絕對濃度。任何使pH改變的趨勢都可以被緩衝,並通過調節這個比例而得到校正。如在正常代謝反應中形成的大量...
:可測任何PH值在4 ——10之間的無色酸鹼溶液,用本品檢測均可呈現色別表上相應的色澤反應。PH測試劑精確度 編輯 : 可檢測非常弱的緩衝溶液(≥0.005%)或及...
伯瑞坦-羅賓森(Britton-Robinson)是由磷酸、硼酸和醋酸(H3PO4-HAc-H3BO3)混合而成,向其中加入不同量的氫氧化鈉可以組成pH範圍很寬的緩衝溶液,pH1.8~11.9 ...
感測器的校準在發酵罐外進行,將pH電極浸沒到含一種或多種標準緩衝液的適當容器中進行校準。這些操作最好均在發酵罐運行溫度下進行。pH電極需與發酵過程中使用的...
生物緩衝劑 當往某些溶液中加入一定量的酸和鹼時,有阻礙溶液pH變化的作用,稱為緩衝作用,這樣的溶液叫做緩衝溶液。弱酸及其鹽的混合溶液(如HAc與NaAc),弱鹼及其鹽...
正常人血漿的PH值為7.35~7.45。血漿PH值的相對恆定性有賴於血液內的緩衝物質以及正常的肺、腎功能。血漿的緩衝物質包括NaHCO3/H2CO3、蛋白質鈉鹽/蛋白質和...
再用硼砂標準緩衝液校正儀器,再如上法測定;二次pH值的讀數相差應不超過0.1,取二次讀數的平均值為其pH值。(7)配製標準緩衝液與溶解供試品的水,應是新沸過...
電泳緩衝液是核酸、蛋白質凝膠電泳系統的一個重要組成, 是電泳場中的導體,也是維持電泳系統恆定 pH值的必要條件。其成分及其離子強度影 響物質的電泳遷移率,應...
常用的標準緩衝溶液有:鄰苯二甲酸氫鉀溶液,磷酸二氫鉀和磷酸氫二鈉混合鹽溶液,硼砂溶液,KHC8H4O4等。其中IUPAC都規定了具體的濃度及pH標準值。...
複合電極使用前首先檢查玻璃球泡是否有裂痕、破碎,如果沒有,用pH緩衝溶液進行兩點標定時,定位與斜率按鈕均可調節到對應的pH值時,一般認為可以使用,否則可按使用說明...
1 緩衝特性 2 製備 3 套用 Tris緩衝特性 編輯 Tris為弱鹼,在25℃下,它的pKa為8.1;根據緩衝理論,Tris緩衝液的有效緩衝範圍在pH7.0到9.2之間。Tris鹼的水溶...
